Escolar Documentos
Profissional Documentos
Cultura Documentos
Fundamentos Da Eletrodeposicao
Enviado por
rafaelmiguezTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Fundamentos Da Eletrodeposicao
Enviado por
rafaelmiguezDireitos autorais:
Formatos disponíveis
MINISTRIO DA EDUCAO E DO DESPORTO
UNIVERSIDADE FEDERAL DO PARAN
SETOR DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUMICA
FUNDAMENTOS DA ELETRODEPOSIO
INTRODUO
DISCIPLINA : ELETROQUMICA APLICADA E CORROSO
TQ - 417
Prof. Dr. Haroldo de Arajo Ponte
Curitiba
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
2
SUMRIO
1- INTRODUO GERAL 03
2- CONDUO DOS ELETRLITOS 04
3- LEI DE FARADAY 05
4- EFICINCIA DA CORRENTE 07
5- POTENCIAL DO ELETRODO 09
6- SRIES DE FORA ELETROMOTRIZ, FEM 11
7- POTENCIAL DE ELETRODEPOSIO 13
7.1- Deposio a partir de soluo simples 13
7.2- Deposio a partir de mistura de solues 14
8- POLARIZAO E SOBREPOTENCIAL 15
8.1- Sobrepotencial de Concentrao 16
8.2- Polarizao hmica 17
8.3- Sobrepotencial de Ativao 17
9- FATORES QUE AFETAM A VELOCIDADE DE REAO 18
9.1- Controle por Ativao 18
9.2- Transporte de Massa 23
9.2.1 Efeito do Transporte de Massa 24
9.2.2 Amplificao da Rugosidade Superficial 26
9.2.3 Surgimento e crescimento de Dendritas 27
9.2.4 Formao de P 27
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
3
1- INTRODUO GERAL
Uma reao eletroqumica um processo qumico heterogneo (que
envolve uma interface slido/soluo) envolvendo a transferncia de cargas
para ou de um eletrodo, geralmente um metal ou semicondutor.
A transferncia de carga
pode ser um processo catdico
no qual uma espcie reduzida
pela transferncia de eltrons
do eletrodo. Exemplos de tais
reaes na tecnologia
eletroqumica incluem:
(1) 2 2 2
2 2
H O e H OH + +
(2) Cu e Cu
2
2
+
+
(3) PbO H SO e PbSO H O
2 4
2
4 2
4 2 + + + +
+
2
Ao contrrio, a transferncia de carga pode ser um processo andico
onde uma espcie oxidada pela remoo de eltrons para o eletrodo e
exemplos deste caso so:
(4) 2 4 4
2 2
H O e O H +
+
(5) 2 2
2
Cl e Cl
(6) Ce e Ce
3 4 + +
(7) Pb SO e PbSO +
4
2
4
2
Um processo eletroqumico s possvel em uma cela que apresente
ambas as reaes catdica e andica de forma a se manter um balano de
cargas, isto , a quantidade de carga envolvida no processo de reduo tem
que ser a mesma que a envolvida no processo de oxidao.
Q
a
= Q
c
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
4
A variao qumica total na cela determinada pela adio de duas
reaes individuais no eletrodo, desta forma a variao qumica numa bateria
de chumbo/cido obtida pela adio das reaes (3) e (7), isto :
(3) PbO H SO e PbSO H O
2 4
2
4 2
4 2 + + + +
+
2
2
(7) Pb SO e PbSO +
4
2
4
2
Reao Global : PbO Pb SO H PbSO H O
2 4
2
4 2
2 4 2 2 + + + +
+
e para a eletrlise da gua, pela adio das reaes (1) e (4), isto :
(1) (2 2 )x2 2
2 2
H O e H OH + +
(4) 2 4 4
2 2
H O e O H +
+
Reao Global : 2 2
2 2
H O H O +
2- CONDUO DOS ELETRLITOS
A quantidade de carga (corrente) que flui atravs de um eletrlito
depende da voltagem aplicada (potencial) e da resistncia da soluo. Nos
processos de eletrodeposio costuma-se considerar a condutividade ou
condutncia, C, da soluo que o inverso da resistncia, R.
Com um propsito de possibilitar comparaes, utilizam-se termos como
resistncia especfica, , que definida como a resistncia oferecida por 1
cm
3
de soluo, e condutividade especfica, k, que o recproco de . Desta
forma, se "a" a rea dos eletrodos, em centmetros quadrados,
posicionados a uma distncia lde 1cm;
R
l
a
= ou
C k
a
l
=
onde dado em ohm.cm e k em S/cm (Siemens/cm) ou seja, (1/ohm).cm.
Portanto, desejando-se aumentar o fluxo de cargas (corrente) num processo
de eletrodeposio tem-se como alternativas:
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
5
a) melhorar a condutividade especfica do banho pela adio de sais ou
cidos, aumentando assim o nmero de transportadores de carga;
b) aumentar a rea dos eletrodos;
c) diminuir a distncia entre os eletrodos;
d) aumentar a temperatura que, por aumentar a mobilidade dos ons,
causa um aumento da condutividade.
3- LEI DE FARADAY
Para que qualquer reao eletroqumica ocorra numa cela, os eltrons
devem passar atravs de um circuito conectando os dois eletrodos. Por esta
razo, a corrente I se torna uma medida conveniente da taxa de reao na
cela enquanto a carga Q, que passa durante um perodo "t", indica a
quantidade total de reao que ocorreu. Na verdade, a carga necessria para
a converso de "m" moles de um material em produto, em uma reao com
"n" eltrons (onde "n" o nmero de cargas envolvidas na reao),
perfeitamente calculada usando-se a Lei de Faraday:
= = mnF Idt Q
onde F = 96.500C. O nmero de moles do material depositado obtido pela
razo entre o peso do material depositado, P, e seu peso atmico, A, ou seja:
A
P
m =
O Faraday , portanto, por definio, a carga necessria para se
depositar um equivalente eletroqumico de um material, ou seja m/n = e.
O equivalente eletroqumico, e, usualmente expresso em miligramas
ou em gramas por Ampere por hora (g/Ah) como verificado na Tabela abaixo.
A quantidade de energia , normalmente, medida em Ah e o Faraday iqual
a 26,8 Ah.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
6
Metal Valncia Peso Atmico Equivalente
Eletroqumico (g/Ah)
Cromo 6 52,00 0,323
Cobre 1 63,54 2,372
Ferro 3 55,85 1,042
Chumbo 2 207,19 3,865
Nquel 2 58,71 1,095
Estanho 2 118,69 2,213
Zinco 2 65,38 1,220
EXEMPLOS
a) Clculo do Peso do Depsito
Est sendo depositado cobre, a uma densidade de corrente de 2 A/dm
2
sobre uma rea total de 25 dm
2
, a partir de um banho cido de cobre. A
corrente utilizada de 50 A e a deposio dura 30 min. Ento, o peso do
cobre, P, depositado obtido utilizando-se a equao:
P
It A
n
=
96 500 .
.
em que "n"=2 (Cu
2+
), de forma que se obtem P = 29,63g.
b) Clculo da Espessura do Depsito
Qual a espessura do depsito obtido, L, no exemplo acima.
L
P
ad
=
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
7
onde "a" a rea depositada e "d" a densidade do material depositado.O
cobre tem uma densidade d=8,93 g/cm
3.
Aplicando-se a equao acima obtem-se que L = 13,27um ( 1um =
1x10
-4
cm).
c) Clculo do Tempo de Durao do Processo
Numa empresa de deposio, deve-se saber calcular o tempo
necessrio para se obter uma determinada espessura de depsito.
Considerando-se a deposio do cobre e que se deseja depositar 25um de
espessura a uma densidade de corrente de 2 A/dm
2
sobre uma rea de 25
dm
2
. Qual o tempo necessrio para este processo?
(i) clculo inicial do volume de depsito do metal, V = a . L = 6,25cm
3
.
(ii) clculo do peso do depsito, P = V . d = 55,82g.
(iii) aplicao da Lei de Faraday, P
It A
n
=
96 500 .
. = 0,9877t
de forma que aplicando-se (ii) em (iii) obtem-se que t = 56,52min.
4- EFICINCIA DA CORRENTE
Num processo de deposio, espera-se que toda a corrente aplicada
seja utilizada para a eletrodeposio do material de interesse. Se uma frao
desta corrente for utilizada por algum outro processo (em paralelo) ela
considerada desperdiada. Infelizmente, de uma maneira geral isto ocorre.
Por exemplo, na deposio do nquel, uma certa quantidade de hidrognio
reduzida juntamente com o nquel. O mesmo ocorre com o cobre e outros
metais. Um caso mais grave a deposio do cromo em que a maior parte
da corrente gasta na reduo de hidrognio levando a uma eficincia de 12
a 16 % de deposio de cromo. Desta forma definiu-se a eficincia de
corrente na eletrodeposio, ou eficincia catdica, como sendo a
porcentagem da corrente total que utilizada na deposio catdica do
metal, ou medindo-se a carga envolvida no processo, isto :
100 100 % x
m
m
x
q
q
terico
dep
terico
proceso
= =
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
8
Para medir a carga q utiliza-se um ampermetro em srie e um
cronmetro. A quantidade de material depositado obtida pela variao no
peso e a quantidade terica de material que deveria ser depositado dado
pela Lei de Faraday e a carga q medida.
Os possveis erros na medida da eficincia so:
- flutuaes na corrente durante o perodo de deposio;
- impreciso no ampermetro;
- impreciso na medida do tempo.
Alternativamente, pode ser utilizado um medidor de Ampere-hora ou um
coulometro.
O coulometro consiste num aparelho, acoplado em srie com o banho, em
que se faz uma deposio com 100% de eficincia de corrente. Um exemplo
de coulometro consiste em utilizar anodo e catodo de cobre numa soluo de:
- CuSO
4
150g/l
- H
2
SO
4
50 g/l
- Alcool etlico 50 g/l
Considere que para a deposio de 1g de cobre so necessrios 3.037
Coulombs.
O conhecimento da quantidade total de eletricidade que passou durante um
processo til para os seguintes propsitos:
- reposio de reativos qumicos no banho, que pode ser previsto
baseado em Ah de trabalho;
- reposio de aditivos, abrilhantadores, niveladores, aliviadores de
tenses, etc, que pode tambem ser baseado em Ah;
- clculo de quantidade de material depositado;
- o custo do processo pode ser baseado em Ah consumidos.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
9
5- POTENCIAL DO ELETRODO
Considere um metal puro imerso numa soluo aquosa (eletrlito), por
exemplo cobre em sulfato de cobre ( CuSO ). O que acontece na superfcie
do metal?
4
Na superfcie do metal iro ocorrer duas reaes sendo uma catdica e
outra andica. As reaes so, respectivamente:
Cu e Cu
2
2
+
+ (reao catdica)
Cu Cu e +
+ 2
2 (reao andica)
Aps um certo tempo ser atingido um equilbrio entre estas reaes de
forma que a taxa de reduo (reao catdica) se iguala taxa de oxidao
(reao andica). Neste momento, pode-se representar, esquematicamente,
a interface eletrodo/soluo, marcada pelo circulo na figura acima, da
seguinte forma:
onde se observam os dipolos (molculas de gua) adsorvidos na superfcie
do metal bem como nions especficamente adsorvidos, isto , atrados por
interaes qumicas e no eltricas. Tambm esto representados os ctions
metlicos que encontram-se cercados por uma bainha de solvatao. Esta
estrutura formada na interface entre o metal e a soluo, que se assemelha a
de um capacitor, denominada de Dupla Camada.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
10
A primeira linha, traada paralelamente superfcie do metal,
representa o plano que corta a regio central das cargas dos dipolos. Este
plano denominado de Plano Interno de Helmholtz, PIH. A segunda linha
traada representa o plano que corta a regio central das cargas dos ctions
solvatados mais prximos da superfcie do metal. Este plano denominado
de Plano Externo de Helmholtz, PEH. A regio compreendida entre o PEH
e a superfcie do metal denominada de Camada de Helmholtz ou
simplesmente Camada Interna ou Compacta.
A regio compreendida entre o PEH e a regio em que a concentrao
de ctions solvatados passa a ser constante, isto , no seio da soluo,
denominada de Camada Difusa. A maior concentrao dos ctions, nas
proximidades da superfcie do metal, deve-se ao fato da existncia de foras
de atrao de origem eletrosttica entre a sua carga e a da superfcie do
metal. Porm, devido agitao trmica, quanto mais distante se est da
superfcie do metal, menor a influncia das foras de atrao e,
conseqentemente, mais uniformemente estes ctions estaro distribuidos.
Observa-se, portanto, que se forma, como j comentado, uma estrutura
semelhante a de um capacitor apresentando uma diferena de potencial entre
a superfcie do metal e a soluo. Esta diferena de potencial tem uma
variao como mostra o grfico a seguir:
Neste grfico observa-se uma diferena entre o potencial do metal, E
cu
,
e o potencial da soluo, E
sol
, que corresponde ao potencial em que a
concentrao de ctions se torna constante.
Esta diferena de potencial que corresponde ao potencial do eletrodo
e representada pela Equao de Nernst:
C
nF
RT
E E
o
log
3 , 2
'
+ =
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
11
onde R a constante dos gases (8,314j/molK), T a temperatura da soluo
( em Kelvin), "n" a valncia do ction, F o Faraday (96.500C) e C a
concentrao dos ctions em soluo. O E
o
o Potencial Formal do metal,
isto , o potencial quando a concentrao deste em soluo igual a 1 molar.
Considerando-se que a temperatura da soluo seja a ambiente, o termo
2,3RT/F assume o valor de 0,059. Desta forma a Equao de Nernst pode
ser simplificada para:
C
n
E E
o
log
059 , 0
'
+ =
INFORMAES
a) Considerando-se que o potencial dos eletrodos tem um valor em
torno de 1V e que a espessura da Camada Interna de cerca de 1 nm, teria-
se uma intensidade de campo eltrico da ordem de 10
7
V/cm.
b) A espessura da Camada Difusa, para uma concentrao de ctions >
10
-2
M , menor que 30 nm, ou seja 3x10
-2
um.
6- SRIES DE FORA ELETROMOTRIZ, FEM
Baseado no discutido acima, para se determinar o valor do Potencial
Padro de um metal, basta introduzir uma amostra deste metal puro numa
soluo contendo uma concentrao conhecida de seus ons, medir o
potencial do eletrodo e aplicar a equao de Nernst.
Surge aqui uma questo. Como se medir o potencial do eletrodo?
Logicamente, para se medir o potencial do eletrodo (interface
metal/soluo) utiliza-se um voltmetro de alta impedncia (alta resistncia),
para que no passe corrente. Porm a medida tem que ser feita entre dois
pontos, isto , entre dois eletrodos. Desta forma no mais se estar medindo
o potencial de um eletrodo e sim a diferena entre os potenciais dos dois
eletrodos. Para resolver este problema, convencionou-se que o potencial de
um eletrodo de hidrognio, numa soluo 1M de HCl, a uma temperatura de
25
o
C e a uma presso de 1atm, seria zero. Sendo assim, ao se medir a
diferena entre o potencial do eletrodo de hidrognio, numa soluo 1 normal,
(EHN) e o de um metal, tem-se o "potencial do eletrodo".
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
12
Uma vez que h dificuldades em se manusear um EHN, outros
eletrodos de referncia so utilizados, como o Eletrodo de Calomelano
Saturado ECS. Este eletrodo consiste num contato entre mercrio, cloreto
mercuroso e uma soluo saturada de cloreto de potssio.
APLICAO DAS SRIES FEM
a) Troca inica
Uma pea de zinco imersa numa soluo de CuSO . O que ocorre?
4
Dados: E
o(Zn
2+
)
= -0,76V e E
o(Cu
2+
)
=+0,34V para reao de
reduo, portanto ir fluir eltrons do zinco, cujo potencial mais negativo,
provocando a reduo do cobre em sua superfcie, conforme as reaes:
Zn e Zn
+
2
2
Cu e Cu
2
2
+
+
b) Descarga de Hidrognio
Os metais com potencial de reduo mais negativo que o do hidrognio
tm a capacidade de promever, atravs da reduo do hidrognio, a evoluo
de bolhas de hidrognio. Como exemplos tem-se o caso do ferro em HCl ou o
caso de metais como o K, Na e Mg em gua.
c) Banhos Strike
Um banho strike formulado de forma a diminuir a diferena entre o
potencial de um metal e de uma soluo, para se evitar a troca inica. Um
exemplo :
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
13
Deposio de prata sobre cobre. A prata apresenta um potencial
padro de reduo E
o
=+0,80V enquanto que o potencial padro do cobre
de E
o
=+0,34V de forma que se tem uma diferena de 0,46V. Devido a esta
diferena, quando se introduz a pea de cobre no banho de prata,
imediatamente ocorre uma reao de troca inica, isto , a prata se deposita
sobre o cobre, com conseqente dissoluo do cobre. O depsito de prata
assim obtido, entretanto, no apresenta aderncia nem boas caractersticas
fsicas.
O que se faz ento reduzir a diferena entre os potenciais, do cobre e
do banho de prata, atravs da diminuio da concentrao de ons prata em
soluo. Desta forma, pela equao de Nernst, uma soluo com 0,01M de
prata apresentaria um potencial de 0,68V reduzindo a diferena entre os
potenciais de 0,46V para 0,34V. A partir deste banho, podera-se obter
depsitos com melhor qualidade e caso queira-se obter uma maior
espessura, aps uma deposio inicial de prata na soluo diluda, podera-
se passar para uma outra soluo com maior concentrao de prata sem
prejuizos.
7- POTENCIAL DE DEPOSIO
7-1 DEPOSIO A PARTIR DE SOLUO SIMPLES
Considere o caso de duas peas de cobre imersas em uma soluo de
. Aplique uma diferena de potencial de forma a tornar uma delas
catdica e outra andica. aumente lentamente a diferena de potencial
aplicado e observe o momento em que comea a ocorrer a deposio no
catodo. O potencial no catodo, nesse instante, chamado de
CuSO
4
Potencial de
Deposio do cobre.
Se este valor de potencial for comparado com o potencial reversvel E
do cobre, na soluo particular do experimento, ser notado que eles so
aproximadamente o mesmo. Tal propriedade observada para vrios outros
metais.
Em resumo, diz-se, nesse caso, que o metal forma um Eletrodo
Reversvel.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
14
O que esta propriedade reversvel significa na prtica? O que o
potencial de deposio significa para uma deposio na prtica?
Tome o caso da deposio do cdmio a partir de CdSO , contendo
11,24g de cdmio em 1 litro ( concentrao 0,1M).
4
Peso atmico do cdmio = 112,4g/mol
Concentrao de ons Cd na soluo = 0,1molar
Potencial padro do Cd = -0,40V Cd /
2+
Potencial E = -0,40 + (0,059 log0,1)/2 = -0,43V
Como o cdmio um eletrodo reversvel, seu potencial de deposio,
nessa soluo, ser de -0,43V. Portanto, desejando-se depositar cdmio, a
partir dessa soluo, o potencial do catodo deve ser de -0,43V.
7-2 DEPOSIO A PARTIR DE MISTURA DE SOLUES
Suponha que se esteja eletrolisando uma soluo contendo dois ons
diferentes, como o zinco e o cdmio, isto , uma mistura de solues de
eCdSO , cada uma com concentrao inica de metal de 1g on/l (
concentrao 1M).
ZnSO
4
4
Observa-se, na prtica , que, na ausncia de fatores complicantes, cada
espcie inica depositada, uma aps a outra, a medida que o catodo atinge
os potenciais especficos de cada metal. O potencial padro do Cd e do Zn
so -0,40V e -0,76V, respectivamente. No incio, quando o potencial atinge -
0,40V, o cdmio depositado isoladamente, uma vez que seu potencial
padro relativamente menos negativo que o zinco. Se o potencial do catodo
mantido neste valor, apenas o cdmio se deposita. A medida que a
eletrodeposio prossegue, a concentrao de ons cdmio no banho
diminue tornando o potencial de deposio deste mais negativo (conforme a
Eq. de Nernst). Chega-se um momento em que potencial pode atingir o valor
do potencial de deposio do zinco, que por sua vez passa a se depositar
simultaneamente com o cdmio.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
15
Uma outra forma de se proceder a deposio de cdmio e zinco se
aplicar, j no incio do processo, um potencial em que se tenha a deposio
do zinco. Desta forma, ocorrer a deposio simultnea de Cd/Zn.
8- POLARIZAO E SOBREPOTENCIAL
Um nmero de outros metais se comportam irreversivelmente como, por
exemplo, ferro, cobalto, nquel, etc. O que isso significa na prtica?
Para o nquel, o potencial padro Eo = -0,25V. Portanto, num processo
de deposio de nquel a partir de uma soluo de 1M espera-se o
incio da deposio, no catodo, quando o potencial atingir -0,25V. Mas isso
no ocorre. O potencial de incio do processo de deposio do nquel nessa
soluo de cerca de -0,45V, isto , aproximadamente 0,20V mais negativo
que o valor do Eo. Em outras palavras, um
4
NiSO
potencial extra necessrio para
a deposio do nquel.
Isto tambm ocorre quando se deseja passar uma maior corrente
atravs do eletrodo a fim de que a reao de deposio ocorra a uma maior
taxa. Mesmo no caso dos eletrodos reversveis, um potencial extra
necessrio.
A princpio, diz-se que o eletrodo est POLARIZADO e que a diferena
numrica entre o potencial do eletrodo de trabalho e seu potencial reversvel
chamada de SOBREPOTENCIAL.
Quando o sobrepotencial referido tem origem no processo de
deposio, ele chamado de sobrepotencial de deposio. Em geral, mesmo
a baixas densidades de corrente ocorre polarizao e a magnitude depende
das condies de trabalho e da natureza do processo de reduo dos ons. A
presena de um sobrepotencial torna o potencial de deposio do catodo
mais negativo.
O sobrepotencial total observado no eletrodo composto por vrias
componentes, entre elas:
a) sobrepotencial de concentrao
b) Polarizao hmica ou por resistncia
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
16
c) sobrepotencial de ativao
8-1 SOBREPOTENCIAL DE CONCENTRAO
C
Considere a eletrlise em uma soluo de com um eletrodo de
zinco. Quando passamos uma corrente atravs da soluo, os ons de zinco
na soluo prximos do catodo se reduziram incorporando-se ao catodo de
zinco. Isso resulta na diminuio da concentrao de ons na vizinhana
imediata do catodo. A figura abaixo apresenta o perfil de concentrao, C,
com a distncia da superfcie do eletrodo, x, onde C1 e C2 so as
concentraes aps um certo tempo T1<T2, e C* a concentrao no seio
da soluo.
4
ZnSO
A reposio dos ons de Zn consumidos feita atravs de processos de
transporte de massa como a migrao, difuso e conveco, a partir do seio
da soluo.
Na ausncia de variaes na densidade do banho, a conveco
depende de diferenas de temperatura. Uma vez que as diferenas de
temperatura no so significativas, a contribuio da conveco pode ser
desprezada.
A migrao dos ons depende do nmero e natureza dos ons presentes
(ons transportadores de carga). Geralmente, as solues de deposio
contm cidos ou outros eletrlitos em quantidade suficiente para que a
maior parte da corrente seja transportada por eles ( ) .
+
OH H ,
Portanto, conclui-se que a reposio dos ons de Zn, removidos da
soluo pela deposio no catodo, , praticamente, dependente da difuso.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
17
O resultado desta variao de concentrao dos ons de Zn na
superfcie do eletrodo, torna, portanto (de acordo com Nernst), o potencial do
catodo mais negativo que seu valor reversvel. Esta variao no potencial
chamada de SOBREPOTENCIAL DE DIFUSO ,
d
.
Outra forma de se ter
C
quando se tem evoluo de H
2
, pois isso
causa a diminuio da concentrao de na superfcie do catodo, que
leva a um aumento relativo da concentrao de OH . Como resultado, pode
ocorrer a formao e precipitao de hidrxidos ou sais metlicos ( ),
reduzindo a concentrao de Ni e causando um SOBREPOTENCIAL DE
REAO,
+
H
2
) (OH Ni
2+
r
. Uma forma de se reduzir este efeito se aumentar a
concentrao de H ou se utilizar tampes.
+
O sobrepotencial de Concentrao ser, portanto, a soma dos
sobrepotenciais de difuso e de reao.
8-2.POLARIZAO HMICA
Quando o eletrodo recoberto com um filme pouco condutor, tal como
uma camada de xido, sulfato, sal insolvel, graxa, gs ou outro material
isolante, ou camada de lquido pouco condutora, a resistncia dessas
camadas diferente da do eletrlito. Isto torna necessrio um aumento no
potencial aplicado para o processo de deposio.
Tambm, durante o processo de deposio, se mantem uma certa
distncia entre o catodo e o anodo de forma que sempre se ter uma
resistncia adicional decorrente da resistividade do eletrlito.
8-3.SOBREPOTENCIAL DE ATIVAO
a
Existem vrios passos envolvidos no processo de eletrodeposio,
comeando com o ons hidratado no seio da soluo e terminando com o
tomo do metal incorporado estrutura metlica no catodo. o passo mais
lento ir decidir a taxa global de reao e chamado de passo determinante.
A lentido de um passo equivalente a uma "resistncia" oferecida ao
processo de deposio e observado atravs de um sobrepotencial. Quando
o passo mais lento a incorporao do on estrutura metlica, tem-se um
sobrepotencial de ativao.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
18
Este sobrepotencial de ativao surge devido ao aumento de cargas
positivas na superfcie do eletrodo devido a no incorporao imediata destas
na rede do metal. No processo de deposio de muitos metais o
a
desprezvel, a menos que a densidade de corrente de deposio seja muito
grande. Para o processo de reduo de metais como o Fe, Co e Ni e de
gases (H
2
, O
2
, etc) o sobrepotencial de ativao no pode ser desprezado.
9-.FATORES QUE AFETAM A VELOCIDADE DE REAO
Considere a reao no eletrodo do tipo O n . Em que O a
espcie que reduzida para R e R a espcie que oxidada para O. Esta
reao ser portanto governada pela velocidade dos seguintes processos:
e R +
a) Transporte de massa da espcie O do seio da soluo para a
superfcie do eletrodo ou da espcie R da superfcie do eletrodo para o seio
da soluo.
b) Tranferncia de eltrons na superfcie do eletrodo provocando a
reduo da espcie O em R ou a oxidao de R em O.
Desta forma, a taxa da reao estar controlada pela etapa que for mais
lenta e a reao estar controlada ou por Transporte (transporte de massa)
ou por Ativao (transferncia de eltrons).
9-1.CONTROLE POR ATIVAO
Considere mais uma vez a reao eletroqumica no eletrodo O
que ocorre numa cela, como a apresentada esquematicamente abaixo.
R ne +
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
19
Esta cela contm dois eletrodos, um de trabalho, ET, com menor rea e
de material inerte (Platina) e um outro de referncia do tipo EHN. A soluo
no compartimento do ET desoxigenada e contm baixas concentraes C
o
e C
R
de espcies eletroativas O e R. Desta forma as caractersticas da cela
so determinadas apenas pelas variaes das propriedades na superfcie do
ET.
Se os dois eletrodos forem conectados e for monitorado o potencial da
cela, verificar-se-a que aps algum tempo o potencial do eletrodo de trabalho
atingir um valor estacionrio, indicando que a cela est em equilbrio. Neste
momento o potencial do ET estar em acordo com a equao de Nernst,
|
|
.
|
\
|
+ =
R
o o
eq
C
C
nF
RT
E E ln
'
em que o potencial de equilbrio, E
eq
, est relacionado ao potencial Formal,
E
o
, do par O/R e s concentraes superficiais, C
o
e C
R
, de O e R.
Observa-se claramente que o potencial de equilbrio assume o valor do
potencial padro quando C
o e
C
R
so iguais. Observa-se tambm que
quando se atinge o equilbrio a corrente indicada no ampermetro zero.
Entretanto, este equilbrio dinmico, isto , na realidade continua a ocorrer
uma reao de oxidao e uma de reduo, porm, com mesma intensidade
de forma que
I I I
= =
0
onde I
o
a corrente de troca e, portanto, a corrente resultante zero.
Se o potencial do ET for deslocado para valores mais negativos que o
potencial de equilbrio, de acordo com a Eq. Nernst, para que o equilbrio seja
reestabelecido, tem que haver um aumento da concentrao de R que
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
20
obtido pela converso de O em R, gerando uma corrente catdica. Ao
contrrio, se o potencial do ET for deslocado para valores mais positivos que
o de equilbrio, ser gerada uma corrente andica, devido converso de R
em O.
Esta previso simplificada do relacionamento entre o potencial e a
corrente est baseada apenas nos aspectos termodinmicos de forma que
tambm necessrio serem considerados os aspectos cinticos da
transferncia de eltrons.
A taxa de reduo de O depende de uma taxa constante, k, e da
concentrao superficial de O, C
o
.
Taxa de Reduo de O = f k C
o
( , )
e portanto a densidade de corrente de reduo dada por
i
I
a
nF k C
o
= =
onde "a" a rea do eletrodo e k dado por
k k
nF
RT
E
o
=
|
\
|
.
|
exp
depende do campo eltrico, prximo da superfcie do eletrodo, que interfere
no movimento de eltrons e, conseqentemente, no potencial aplicado ao
eletrodo, E, e o coeficiente de transferncia de carga, que tem valor entre
0 e 1. Normalmente este parmetro assume uma valor de 0,5. O termo nF
corresponde carga por grama de ons.
A equao da densidade de corrente de reduo assume, ento, a
forma
i nF k C
nF
RT
E
o
o
=
exp
Para a reao de oxidao, seguindo-se o mesmo procedimento,
chega-se equao
( )
i nF k C
nF
RT
E
o
R
=
exp
1
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
21
de forma que a densidade de corrente resultante "i" ser dada pela diferena
entre a densidade de corrente de reduo e da de oxidao
( )
i nF k C
nF
RT
E k C
nF
RT
E
o
o
o
R
=
`
)
exp exp
1
A representao grfica destas curvas apresentada a seguir de forma
a se poder visualizar a curva resultante da densidade de corrente total, a
densidade de corrente de troca e o potencial de equilbrio.
Como no equilbrio a corrente resultante zero tem-se , isto
i
I I I
= =
0
c
(-) = i
a
(+) = i
o
, e portanto pode-se obter que a densidade de corrente de
troca que dada por
( )
i nF k C
nF
RT
E nF k C
nF
RT
E
o
o eq
o
R e 0
1
=
exp exp
q
de forma que se for definido um novo parmetro, o sobrepotencial, como
sendo , que pode ser considerado como o potencial do ET
usando-se o potencial de equilbrio do par O/R como referncia, pode-se
obter uma equao mais simples e fundamentalmente mais importante
= E E
eq
( )
i i
nF
RT
nF
RT
o
=
`
)
exp exp
1
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
22
que conhecida como equao de Butler-Volmer e que apresenta uma forma
de se calcular a relao I-E para qualquer soluo de O em R desde que se
conhea:
a) o potencial padro do par O/R
b) a densidade de corrente de troca, i
o
c) o coeficiente de transferncia de carga,
Para o caso de um processo de deposio, a Eq. de Butler-Volmer se
resume a
i i i
nF
RT
o
= =
exp
de maneira que, passando para a forma logartmica, obtem-se
log log
,
i i
nF
RT
o
=
2 3
ou seja, obtem-se uma expresso do tipo
= + a b i log
onde a e
RT
nF
i
o
=
2 3 ,
log
b
RT
nF
=
2 3 ,
tornando possvel o clculo do valor do coeficiente de transferncia de carga,
a partir do coeficiente angular da regio linear da curva obtida, e da
densidade de corrente de troca, pela extrapolao da regio linear sobre o
eixo de logi para o sobrepotencial igual a zero.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
23
9-2 TRANSPORTE DE MASSA
Em geral, num sistema eletroqumico, necessrio se considerar tres
modos de transporte de massa;
a) Difuso: quando o movimento de espcies ocorre devido a um
gradiente de concentrao.
b) Migrao: quando o movimento de espcies carregadas ocorre
devido a um gradiente de potencial.
c) Conveco: quando o movimento de espcies ocorre devido a um
gradiente de presso.
de forma que o fluxo total de espcies "i" dado por
( ) fluxo D gradC U C grad Cv
i i i i i
= +
i
onde o primeiro termo da direita representa a contribuio devido difuso, o
segundo termo representa a contribuio devido migrao e o terceiro
termo devido conveco.
Com relao ao segundo termo, como na Camada Interna o campo
constante, tem-se que o gradiente de potencial zero e portanto este termo
pode ser desconsiderado.
O terceiro termo, como a velocidade do fluido (eletrlito) na superfcie
do eletrodo zero, tambm pode ser desprezado. Entretanto deve-se resaltar
que a conveco se torna importante na manuteno da concentrao
constante dos ons metlicos entre a camada difusa e o seio da soluo. Uma
maior agitao da soluo diminui a espessura da camada difusa.
O primeiro termo, referente difuso, definido pela 1a Lei de Fick que
relaciona o fluxo (corrente), variao da concentrao das espcies "i" com
a distncia a partir da superfcie do eletrodo. Pode-se tambm utilizar esta Lei
de Fick, juntamente com a Lei de Faraday, para se relacionar a densidade de
corrente variao qumica no eletrodo, atravs do relacionamento do fluxo
de O e R com o fluxo de eltrons
i
nF
D
C
x
o
x
=
|
\
|
.
|
=
0
0
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
24
donde se tem que
i nFD
dC
dx
nFD
C C
o
o
x
o
o o
=
|
\
|
.
| =
=
0
sup
onde a espessura da camada em que a difuso importante, C a
concentrao superficial da espcie O e C a concentrao da espcie O
no seio da soluo. Observa-se nesta equao que, quando C zero, a
densidade de corrente atinge um valor limite definido como Densidade de
Corrente Limite dada pela expresso
o
sup
o
o
sup
i
nFDC
o o
lim
=
Pode-se agora compreender uma curva I-E como a apresentada na
representao da equao de Butler-Volmer, quando se extende a faixa de
variao do potencial atingindo-se a densidade de corrente limite.
9-2-1 EFEITO DO TRANSPORTE DE MASSA
Os depsitos obtidos pela reduo eletroqumica podem apresentar
grandes variaes em sua aparncia externa. eles podem ser extremamente
planos e brilhantes, ou rugosos, granulares, possivelmente dendrticos e
ainda pulverulentos (forma de p). Algumas formas de morfologia superficial
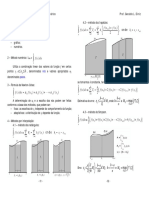
que podem ser obtida, por exemplo, no caso da deposio do zinco, esto
apresentados na figura abaixo.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
25
(a)
(b)
(c)
Dentre os fenmenos fundamentais que provocam o aparecimento de
diferentes morfologias esto : a) a amplificao da rugosidade superficial, b) o
aparecimento de dendritas, c) a formao de depsitos na forma de p. Neste
trabalho ser abordado de forma mais aprofundada os aspectos referentes
amplificao superficial enquanto que ser feito apenas um comentrio com
relao formao de dendritas e de ps.
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
26
9-2-2 AMPLIFICAO DA RUGOSIDADE SUPERFICIAL
A amplificao de irregularidades existentes sobre uma superfcie em
geral um fenmeno observado na deposio de metais a partir de solues
puras de seus sais. A ampliao se torna mais intensa medida que a taxa
de deposio aumenta e a concentrao dos ons metlicos, em soluo,
diminui. Estas condies so algumas das que levam o processo de
eletrodeposio ao controle por transporte de massa, j que desta forma se
aproxima da condio de densidade de corrente limite (veja eq. da densidade
de corrente limite).
Segundo alguns pesquisadores as razes para a deposio mais rpida
nas elevaes so que existe uma menor regio difusional entre a superfcie
onde a deposio ocorre e o plano externo da camada de difuso que no
caso de uma reentrncia, e tambm devido ao fato de que, no topo das
elevaes, as condies de difuso so aproximadas daquelas para difuso
esfrica, que sempre maoir que para o caso linear, devido ao maior campo
difusional.
Um exemplo tpico est representado esquematicamente na figura
abaixo. Neste caso, a amplificao ocorre, obviamente, pelo fato da
deposio ser mais intensa nas regies elevadas que na regio plana, mas
por que isto ocorre?
Na regio plana da superfcie a densidade de corrente limite ser
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
27
i
nFDC
o o
lim
=
j na regio da elevao, a densidade e corrente limite ser dada por
i
nFDC
h
o o
lim
=
de forma que a densidade de corrente limite na regio de elevao maior
que a correspondente regio plana.
9-2-3 SURGIMENTO E CRESCIMENTO DE DENDRITAS
Este tipo de depsito tem sido intensivamente estudado, e um lista de
regras que governam a velocidade do crescimento das dendritas foi
estabelecida. Estas regras so as seguintes: a) o crescimento exige um
tempo de induo; b) deve-se exceder um determinado sobrepotencial crtico
a fim de se provocar o crescimento das dendritas; c) a densidade de corrente
crtica para o cescimento das dendritas est relacionada diretamente
concentrao dos ons a serem depositados; d) a incidncia de dendritas
aumenta com o aumento da densidade de corrente total; e) uma vez que se
observa a presena de dendritas, estas crescem a uma velocidade constante,
dependente do sobrepotencial; f) a taxa com a qual vrias dendritas crescem,
a um determinado sobrepotencial, diferem mas parece existir uma velocidade
limite de propagao, etc.
A causa bsica para o surgimento das dendritas a mesma que
aquelas para a amplificao da rugosidade superficial, isto , a formao de
um campo difusional dos ons a serem depositados, favorecendo o
desenvolvimento de protuberncias dendrticas nadireo das altas
concentraes.
9-2-4 FORMAO DE P
A deposio pulverulenta de metal difere dos depsitos visveis de
dendrita principalmente por um grande grau de disperso que faz com que o
eletrodo se torne preto to rpido quanto se inicie a deposio do metal na
forma de p. Estes depsitos apresentam uma baixssima aderncia ao
substrato podendo ser removido facilmente.
As razes que levam deposio de p so as mesmas que aquelas
para a amplificao da rugosidade superficial ou a formao de dendritas, isto
FUNDAMENTOS DA ELETRODEPOSIO
__________________________________________________________________
28
, o crescimento do depsito do metal, sob controle por transporte de massa,
numa regio de maior gradiente de concentrao das espcies depositadas.
Entretanto, enquanto que a amplificao da rugosidade superficial inicia-se
to rapidamente quanto aparea um gradiente de concentrao qualquer, na
superfcie do eletrodo, com relao ao seio da soluo e enquanto as
dendritas iniciam seu desenvolvimento bem abaixo da corrente limite de
difuso, a obtenso de p s conseguida sob condies de corrente limite
para o processo de deposio.
BIBLIOGRAFIAS PARA CONSULTA
CORROSO, Vicente Gentil.
GALVANOTCNICA PRTICA,
INDUSTRIAL ELECTROCHEMISTRY, Derek Pletcher
ELECTROCHEMISTRY IN INDUSTRY, U. Landau; E. Yeager & D.
Kortan
MODERN ELECTROCHEMISTRY, Vol 2, J. O'M Bockris & A.K.N.
Reddy
FUNDAMENTOS DA ELETROQUMICA TERICA, B. Damaskin; O.
Petri
ELECTROCHEMICAL METHODS, A.J.Bard; L.R.Falkner
Você também pode gostar
- Relatório de Pilha EletroquímicaDocumento10 páginasRelatório de Pilha Eletroquímicaeduarda.lousadoAinda não há avaliações
- Coulometria RelatorioDocumento7 páginasCoulometria RelatorioAna Paula TeixeiraAinda não há avaliações
- Experimento 4Documento5 páginasExperimento 4JessicaAinda não há avaliações
- Lista03 QB76K 2s 2017 PDFDocumento2 páginasLista03 QB76K 2s 2017 PDFsakurachanfanAinda não há avaliações
- Aula - Corrosão - CinéticaDocumento48 páginasAula - Corrosão - CinéticaAlexandre AlvesAinda não há avaliações
- 2-Celula GalvânicaDocumento14 páginas2-Celula GalvânicaBárbara LovatoAinda não há avaliações
- Célula EletrolíticaDocumento6 páginasCélula EletrolíticaHygor PachecoAinda não há avaliações
- Apostila de Potenciometria Parte 1 - CEFET QUÍMICA 2003Documento29 páginasApostila de Potenciometria Parte 1 - CEFET QUÍMICA 2003Vitoria CavalcanteAinda não há avaliações
- Quimica Energia e TranformaçãoDocumento9 páginasQuimica Energia e TranformaçãoIndiel OliverAinda não há avaliações
- Ensaio de Elétrolise LaboratorialDocumento10 páginasEnsaio de Elétrolise Laboratorialisabel fagundesAinda não há avaliações
- Cel GalvanicasDocumento19 páginasCel GalvanicasAdones SalesAinda não há avaliações
- Exercicio Físico Química 2 2017 1Documento5 páginasExercicio Físico Química 2 2017 1Vitor LimaAinda não há avaliações
- EletrodeposicaoDocumento21 páginasEletrodeposicaoJizreel Cristo100% (1)
- PRÁTICA: Pilhas Eletroquímicas: Instituto Federal de Educação, Ciência E Tecnologia Do Ceará Campus QuixadáDocumento6 páginasPRÁTICA: Pilhas Eletroquímicas: Instituto Federal de Educação, Ciência E Tecnologia Do Ceará Campus QuixadáFernanda da Rocha SenaAinda não há avaliações
- Voltametria: Conceitos e TécnicasDocumento21 páginasVoltametria: Conceitos e TécnicasGabrieli Bernardi100% (1)
- CondutimetriaDocumento8 páginasCondutimetriaAndréa Silva100% (2)
- Lista EletroDocumento4 páginasLista EletroMariana MagalhãesAinda não há avaliações
- Aula 5 CoulometriaDocumento32 páginasAula 5 CoulometriaMarcia Veroneze Bisol0% (1)
- Artigo 3 PDFDocumento22 páginasArtigo 3 PDFWilliame RibeiroAinda não há avaliações
- 1a Lista de Exercícios - EletroquímicaDocumento3 páginas1a Lista de Exercícios - Eletroquímicageraldo sousaAinda não há avaliações
- Final 3a Aula (Parte II) 2S 2019 (Potenciometria) 2S 2019 - AaraoDocumento136 páginasFinal 3a Aula (Parte II) 2S 2019 (Potenciometria) 2S 2019 - AaraoWashington Oliveira SousaAinda não há avaliações
- Pilhas Galvânicas - Relatório PUC Minas Experimento 5Documento13 páginasPilhas Galvânicas - Relatório PUC Minas Experimento 5Paulo SantosAinda não há avaliações
- Teste 5 - Maio2022Documento4 páginasTeste 5 - Maio2022Lara CamposAinda não há avaliações
- Células Eletrolíticas 1 PDFDocumento15 páginasCélulas Eletrolíticas 1 PDFLeandro QueirozAinda não há avaliações
- EXP 2 - Constante de Faraday - RoteiroDocumento5 páginasEXP 2 - Constante de Faraday - RoteiroFlavio BaldisseraAinda não há avaliações
- Eletroquimica FinalDocumento50 páginasEletroquimica FinalJoao Victor de Mello Marinho AmaralAinda não há avaliações
- 2º Avaliação de Métodos Eletroanalíticos ARISTIDES REISDocumento9 páginas2º Avaliação de Métodos Eletroanalíticos ARISTIDES REISAristides ReisAinda não há avaliações
- Ficha Preparacao Quimica 1Documento6 páginasFicha Preparacao Quimica 1Bruna MachadoAinda não há avaliações
- Cursinho Etwb 2012: Aspectos Quantitativos Da EletróliseDocumento3 páginasCursinho Etwb 2012: Aspectos Quantitativos Da EletróliseBarbara AlvesAinda não há avaliações
- Polarografia Aula Mia IIDocumento38 páginasPolarografia Aula Mia IISamuel Josex100% (1)
- Prática 9 - Eletrodeposição de NíquelDocumento5 páginasPrática 9 - Eletrodeposição de NíquelJoão Paulo100% (1)
- EletrodeposicaoDocumento18 páginasEletrodeposicaoWillian Suarez0% (1)
- Determinação Experimental Da Condutividade Termica Do CobreDocumento10 páginasDeterminação Experimental Da Condutividade Termica Do CobrekilerfrancisAinda não há avaliações
- FQ 10a - Eletrodeposição Do CobreDocumento5 páginasFQ 10a - Eletrodeposição Do CobreÍcaro MychelAinda não há avaliações
- Sebenta de Ciencias Dos MateriaisDocumento119 páginasSebenta de Ciencias Dos MateriaisJoão TomásAinda não há avaliações
- 1 - Determinação Da Constante de Faraday Por Método EletroquimicoDocumento5 páginas1 - Determinação Da Constante de Faraday Por Método EletroquimicoMariana ReisAinda não há avaliações
- Pilhas Eletroquímicas e Medida de Potencial de EletrodoDocumento10 páginasPilhas Eletroquímicas e Medida de Potencial de EletrodoNatsuSalamanderAinda não há avaliações
- Turmadeagosto Química Eletroquímica Eletrólise 14-10-2022Documento15 páginasTurmadeagosto Química Eletroquímica Eletrólise 14-10-2022lucasgoudardAinda não há avaliações
- 2a Lista de Exercicios Eletroquimica e Metálicas 2014Documento6 páginas2a Lista de Exercicios Eletroquimica e Metálicas 2014Jesus EmanuelAinda não há avaliações
- Experimento 04 - EletrodeposiçãoDocumento7 páginasExperimento 04 - EletrodeposiçãoBetynha AragãoAinda não há avaliações
- Lista 8 - Ciência de MateriaisDocumento4 páginasLista 8 - Ciência de MateriaisSamara SuellenAinda não há avaliações
- Voltametria VFDocumento40 páginasVoltametria VFThaylan AraujoAinda não há avaliações
- Relatório de EletroliseDocumento3 páginasRelatório de EletroliseAna FoguelAinda não há avaliações
- Electroquimica 2 GrupoDocumento27 páginasElectroquimica 2 Grupoguerraldo manuel cucha cuchaAinda não há avaliações
- Experimento 5Documento4 páginasExperimento 5Kyo FakeAinda não há avaliações
- 1º-Desenhe o Ciclo de Born-Haber Com Todos Os Passos IntermédiosDocumento4 páginas1º-Desenhe o Ciclo de Born-Haber Com Todos Os Passos IntermédiosmiguelfilipegralhaalmeidaAinda não há avaliações
- Trabalho Quim 2o emDocumento4 páginasTrabalho Quim 2o emrtrdsAinda não há avaliações
- CoulometriaDocumento8 páginasCoulometriaGrace FernandesAinda não há avaliações
- AP ElectroquímicaDocumento5 páginasAP ElectroquímicaValdimiro VarAinda não há avaliações
- COLUMETRIADocumento21 páginasCOLUMETRIAjubanatoAinda não há avaliações
- Eletroquímica (Nota de Aula e Exercícios)Documento5 páginasEletroquímica (Nota de Aula e Exercícios)Sidney Christ100% (1)
- Atividades 2ºano Pilhas e EletroquímicaDocumento3 páginasAtividades 2ºano Pilhas e EletroquímicaRodrigo de Souza RochaAinda não há avaliações
- Lista 3 EnunciadosDocumento7 páginasLista 3 EnunciadosFelipe FelixAinda não há avaliações
- 3 - VoltametriaDocumento90 páginas3 - VoltametrianeumampereiraAinda não há avaliações
- Lista de Exerccios Do SemestreDocumento23 páginasLista de Exerccios Do SemestreLeonardo MacielAinda não há avaliações
- Parte elétrica e dispositivos elétricos da NR 12: conceitos básicos e fundamentais para a compreensão da normaNo EverandParte elétrica e dispositivos elétricos da NR 12: conceitos básicos e fundamentais para a compreensão da normaNota: 5 de 5 estrelas5/5 (3)
- Varetas Combustíveis Nucleares: Desgaste Mecânico Mitigação através do Recobrimento Superficial de Ligas de ZircônioNo EverandVaretas Combustíveis Nucleares: Desgaste Mecânico Mitigação através do Recobrimento Superficial de Ligas de ZircônioAinda não há avaliações
- Física - UFC - Aula 02 VetoresDocumento2 páginasFísica - UFC - Aula 02 VetoresFísica Caderno de Resoluções100% (1)
- Apostila de Dinâmica I - V1r5Documento118 páginasApostila de Dinâmica I - V1r5Cezar Augusto BelleziAinda não há avaliações
- Lista 24 CinéticaDocumento6 páginasLista 24 CinéticaJoão Paulo EmrichAinda não há avaliações
- Defeitos de InjeçãoDocumento27 páginasDefeitos de InjeçãoCarlos CostaAinda não há avaliações
- ABNT NBR 5733 - 1991 - Cimento Portland de Alta ResistênciaDocumento5 páginasABNT NBR 5733 - 1991 - Cimento Portland de Alta ResistênciaRenata MonteiroAinda não há avaliações
- Hfen10 Teste Formativo 1Documento2 páginasHfen10 Teste Formativo 1Beatriz Silva0% (1)
- Isotonia e HLBDocumento7 páginasIsotonia e HLBVanielle CarlaAinda não há avaliações
- Relatório - MOTOR CCDocumento9 páginasRelatório - MOTOR CCRafael OliveiraAinda não há avaliações
- Lista Física Termodinamica IDocumento2 páginasLista Física Termodinamica IMarcio Jr.Ainda não há avaliações
- Apostila Do Curso Basico de Fotografia DigitalDocumento29 páginasApostila Do Curso Basico de Fotografia DigitalEstormehelsingAinda não há avaliações
- Apostila Eletrônica IIIDocumento45 páginasApostila Eletrônica IIIglaucochacalAinda não há avaliações
- FW22 PDFDocumento1 páginaFW22 PDFmessas930% (1)
- Produção Texto VerbeteDocumento5 páginasProdução Texto VerbetePaula Loureiro FagulhaAinda não há avaliações
- Novo Painel AxorDocumento31 páginasNovo Painel AxorPaulo Feitoza100% (4)
- Relatório Extração Com SolventesDocumento6 páginasRelatório Extração Com SolventesAdriana TeixeiraAinda não há avaliações
- Curva HistereseDocumento7 páginasCurva Histeresecubic14Ainda não há avaliações
- 007 - Cálculo Numérico - IntegraçãoDocumento3 páginas007 - Cálculo Numérico - Integraçãomaciel_araújoAinda não há avaliações
- Rotacao 2Documento10 páginasRotacao 2Henrique MarceloAinda não há avaliações
- ND45 - Rev05 Ago - 2018Documento139 páginasND45 - Rev05 Ago - 2018João P MAinda não há avaliações
- 1.4. Aceleração e Classificação de MovimentosDocumento6 páginas1.4. Aceleração e Classificação de Movimentossaturnino fariaAinda não há avaliações
- Chavetas 1Documento31 páginasChavetas 1newton velasquesAinda não há avaliações
- Manual Som Automotivo JVC KD-G299Documento4 páginasManual Som Automotivo JVC KD-G299Erick Santiago CardosoAinda não há avaliações
- EletrodinâmicaDocumento55 páginasEletrodinâmicaAline Werlich100% (1)
- WEG Verniz Imp Lacktherm 1313 H Boletim Tecnico Portugues BR PDFDocumento2 páginasWEG Verniz Imp Lacktherm 1313 H Boletim Tecnico Portugues BR PDFRodrigo Santos VieiraAinda não há avaliações
- D&D 5E - Moderno 5E - Biblioteca Élfica PDFDocumento68 páginasD&D 5E - Moderno 5E - Biblioteca Élfica PDFRafael RP Gomes100% (3)
- Singer 270Documento77 páginasSinger 270negaobola8100% (3)
- Delphi Multec - Injeção EletrônicaDocumento37 páginasDelphi Multec - Injeção EletrônicaSolange Silva SeabraAinda não há avaliações
- Prof. Guimarães - Fisica 1 - Questões 10Documento14 páginasProf. Guimarães - Fisica 1 - Questões 10th146ogalvaoAinda não há avaliações
- 1045520-Lista de Exercícios de DinâmicaDocumento5 páginas1045520-Lista de Exercícios de DinâmicaovoAinda não há avaliações
- 4 - SSR (Sistemas de Tração)Documento74 páginas4 - SSR (Sistemas de Tração)Evandro FragaAinda não há avaliações