Escolar Documentos
Profissional Documentos
Cultura Documentos
Equilibrio Quimico e Constantes de Equilíbrio
Enviado por
Olavo RimoliDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Equilibrio Quimico e Constantes de Equilíbrio
Enviado por
Olavo RimoliDireitos autorais:
Formatos disponíveis
Equilíbrio químico e constante de equilíbrio
Por Camila Salgado de Paula Professora de Química do Colégio Qi
EQUILÍBRIO QUÍMICO
O equilíbrio químico é atingido quando, na mistura reacional, as velocidades das reações direta (reagentes
formando produtos) e inversa (produtos formando regenerando os reagentes) ficam iguais.
Mas, em primeiro lugar, é importante entender que reação química é um processo onde reagentes se
combinam e formam novas substâncias com propriedades diferentes. Algumas reações se processam
totalmente, enquanto outras parecem parar antes de estarem completas. Isso tem a ver com a reversibilidade
da reação. Em uma reação reversível os reagentes formam os produtos, mas os produtos reagem entre si e
regeneram os reagentes.
Por exemplo, a produção da amônia ocorrendo em recipiente fechado, sob pressão e temperatura constantes:
N2(g) + 3H2(g) ⟺ 2NH3(g)
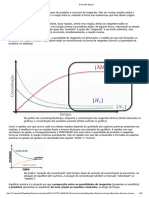
O processo é dinâmico, ou seja, a reação ocorre nos dois sentidos. Consideremos a reação hipotética
entre a mols de A e b mols de B, formando c mols de C e d mols de D:
aA + bB ⟺ cC + dD
Inicialmente, observando uma determinada quantidade de A e B e concentrações de C e D nulas. No
decorrer da reação, as concentrações de A e B diminuem e de C e D aumentam. A velocidade da reação
inversa, que é nula a princípio, cresce continuamente com o tempo. A velocidade da reação direta diminui e
da inversa aumenta, até que atinjam a igualdade. Nesse momento as substâncias A e B se formam na mesma
velocidade em que são consumidas. As concentrações de reagentes e produtos não mais se alteram. Este é o
instante no qual a mistura reacional atingiu o equilíbrio.
Variação entre velocidade e tempo. No equilíbrio, velocidades se igualam. (Foto: Wikicommons)
No estado de equilíbrio, mesmo com o sistema aparentando estar parado, as reações diretas e inversas
continuam a ocorrer, com velocidades iguais. Por isso as concentrações das substâncias permanecem
constantes. Por exemplo, na reação de produção de amônia:
No equilíbrio, as concentrações de produtos e reagentes são constantes (Foto: Wikicommons)
CONSTANTES DE EQUILÍBRIO
Constante de equilíbrio em termos de concentração (Kc)
A constante Kc é denominada constante de equilíbrio em termos de concentração, e é uma grandeza com
valor específico para uma dada reação e temperatura, independente das concentrações iniciais, volume do
recipiente ou pressão.
A expressão da constante de equilíbrio obtém-se pela multiplicação das concentrações dos produtos, estando
elevadas a potências iguais aos respectivos coeficientes da equação balanceada, dividindo-se esse produto
pelo produto das concentrações dos reagentes, cada qual também elevada à potência igual ao respectivo
coeficiente estequiométrico.
Para o equilíbrio hipotético:
aA + bB ⟺ cC + dD
Onde A, B, C e D representam reagentes e produtos e a, b, c e d os respectivos coeficientes
estequiométricos. A expressão da constante de equilíbrio é:
Kc = [C]c⋅[D]d[A]a⋅[B]b
A concentração molar está simbolizada pela fórmula da substância entre colchetes. Exemplo:
Para a reação de formação da amônia temos:
N2(g) + 3 H2(g) ⟺ 2 NH3(g)
Kc = [NH3]2[N2]⋅[H2]3
O fato de os produtos estarem no numerador e os reagentes no denominador, significa que quanto maior o
valor do numerador, maior o valor do Kc e maior tendência de formação dos produtos. Logo, quanto maior
for o valor da constante Kc , maior será o rendimento da reação, ou seja, haverá o favorecimento na
formação de produtos e a concentração destes presentes no sistema será maior que a concentração dos
reagentes. E quanto menor o valor do Kc, menor o rendimento da reação, isto é, maior a concentração de
reagentes em relação aos produtos.
O equilíbrio químico pode ser homogêneo ou heterogêneo.
Equilíbrio homogêneo → reagentes e produtos constituem uma única fase.
Exemplo:
H2(g) + Cl2(g) ⟺ 2 HCl(g)
Equilíbrio heterogêneo → reagentes e produtos constituem mais de uma fase.
Exemplo:
Na2CO3(s) ⟺ Na2O(s) + CO2(g)
Na expressão de constante de equilíbrio não devem ser incluídas substâncias nos estados sólidos ou líquidos,
pois suas concentrações molares são constantes.
NH3(aq) + H2O(l) ⟺ NH+4(aq) + OH−(aq)
Constante de equilíbrio em termos de pressão parcial (Kp)
O Kp é aplicável a equilíbrios homogêneos gasosos, ou equilíbrios heterogêneos, cuja constante de
equilíbrio é função apenas do componente gasoso. Para o equilíbrio hipotético abaixo, sob V, P e T constantes,
temos:
aA + bB ⟺ cC + dD
Kp = (PC)c⋅(PD)d(PA)a⋅(PB)b
Onde:
Kp = constante de equilíbrio em função das pressões parciais.
PA= pressão parcial do reagente A em equilíbrio
PB = pressão parcial do reagente B no equilíbrio
PC= pressão parcial do reagente C no equilíbrio
PD = pressão parcial do reagente D no equilíbrio
O Kp tem valor constante para uma dada temperatura, independente das pressões parciais iniciais, volume
do recipiente ou pressão. Na2CO3(s) ⟺ Na2O(s) + CO2(g)
Kp = (PCO2)
Relação entre Kp e Kc
Kp=Kc(RT)Δn
Onde:
R é a constante universal dos gases (se P é em atm e V em L, R = 0,082 atm.L.mol−1 .K−1);
T é a temperatura absoluta (kelvin);
Δn é a diferença entre a soma dos coeficientes estequiométricos dos produtos e a soma dos coeficientes
estequiométricos dos reagentes.
Exemplo:
2 H2(g) + O2(g) ⟺ 2 H2O(g)
Se o Kc = 3,3 . 1081 e T = 25°C, o Kp valerá:
Kp = 3,3 . 1081 . (0,082 . 298)−1
Kp = (3,3⋅1081)0,082⋅298 / ( 0,082 .298)
Kp = 1,4 . 1080
EXERCÍCIO
(PUC-RJ 2008) Reações químicas dependem de energia e colisões eficazes que ocorrem entre as moléculas dos
reagentes. Em sistema fechado, é de se esperar que o mesmo ocorra entre as moléculas dos produtos em menor
ou maior grau até que se atinja o chamado “equilíbrio químico”.
O valor da constante de equilíbrio em função das concentrações das espécies no equilíbrio, em quantidade
de matéria, é um dado importante para se avaliar a extensão (rendimento) da reação quando as
concentrações não se alteram mais.
Considere a tabela com as quantidades de reagentes e produtos no início e no equilíbrio, na temperatura de
100°C, para a seguinte reação:
Tabela com
quantidade de reagentes e produto (Foto: Reprodução)
A constante de equilíbrio tem o seguinte valor:
a) 0,13
b) 0,27
c) 0,50
d) 1,8
e) 3,0
Gabarito
Letra B. A constante de equilíbrio em função das concentrações (Kc) não depende das concentrações
iniciais, logo:
Kc = (0,09)20,03
Kc = 0,27
Você também pode gostar
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações
- Equilíbrio Químico na Escola Vidal RamosDocumento15 páginasEquilíbrio Químico na Escola Vidal RamosJean de Liz RosaAinda não há avaliações
- Apfq05. Equilíbrios MolecularesDocumento18 páginasApfq05. Equilíbrios MoleculareselizaAinda não há avaliações
- Equilíbrio QuímicoDocumento13 páginasEquilíbrio QuímicojoelalonsoprAinda não há avaliações
- Aula 1 QF 2Documento17 páginasAula 1 QF 2Cintya Dos SantosAinda não há avaliações
- CAPITULO VII - Equilibrio QuimicDocumento9 páginasCAPITULO VII - Equilibrio QuimicHélder ViegasAinda não há avaliações
- Equilíbrio QuímicoDocumento25 páginasEquilíbrio QuímicoJoão PitrezAinda não há avaliações
- Equilíbrio químico: reações reversíveis e constante KcDocumento10 páginasEquilíbrio químico: reações reversíveis e constante KcAbreu Ngongo Filipa KasanjiAinda não há avaliações
- QMC AP Equilíbrio Químico Equilíbrio QuímicoDocumento13 páginasQMC AP Equilíbrio Químico Equilíbrio QuímicoGabriel Lima PizanoAinda não há avaliações
- Cinética Das Reações QuímicasDocumento7 páginasCinética Das Reações QuímicasCassio Rosa Dos SantosAinda não há avaliações
- Caderno de QuimicaDocumento9 páginasCaderno de QuimicaUelder Jeferson SantosAinda não há avaliações
- 06Q - Extensão Das Reações QuímicasDocumento30 páginas06Q - Extensão Das Reações Químicasdiana BaptistaAinda não há avaliações
- Apostila 5 - Equilíbrio QuímicoDocumento39 páginasApostila 5 - Equilíbrio QuímicoGustavo MarinhoAinda não há avaliações
- Equilíbrio Químico: Constantes de Equilíbrio e Quociente de ReaçãoDocumento11 páginasEquilíbrio Químico: Constantes de Equilíbrio e Quociente de ReaçãoGiovanna HikariAinda não há avaliações
- Equilíbrio QuímicoDocumento94 páginasEquilíbrio QuímicoMicheleAinda não há avaliações
- Equilíbrio QuímicoDocumento43 páginasEquilíbrio QuímicoSarah MartinsAinda não há avaliações
- Química - 11º Ano: Equilíbrio QuímicoDocumento62 páginasQuímica - 11º Ano: Equilíbrio QuímicoTeresa MinasAinda não há avaliações
- Equilibrio QuimicoDocumento44 páginasEquilibrio QuimicoJohnatas MathewsAinda não há avaliações
- Licao 10-Equilibrio-Quimico-EAD-2019Documento14 páginasLicao 10-Equilibrio-Quimico-EAD-2019Francisco Tomás FranciscoAinda não há avaliações
- Equilíbrio químico: conceitos e perturbaçõesDocumento43 páginasEquilíbrio químico: conceitos e perturbaçõesLucas MarcelinoAinda não há avaliações
- Química - Equilíbrio QuímicoDocumento29 páginasQuímica - Equilíbrio QuímicoANHAN ANA SilVAAinda não há avaliações
- Equilibrio QuímicoDocumento13 páginasEquilibrio QuímicoGISELLE FRANCINE BRITO MUNIZAinda não há avaliações
- Equilíbrio QuímicoDocumento73 páginasEquilíbrio Químicoamanda mirandaAinda não há avaliações
- 3-Equilíbrio Químico (Apostila)Documento14 páginas3-Equilíbrio Químico (Apostila)Vaniely SiqueiraAinda não há avaliações
- A vida a altitudes elevadas e a produção de hemoglobinaDocumento40 páginasA vida a altitudes elevadas e a produção de hemoglobinaAdemir PereiraAinda não há avaliações
- Equilibrio QuimicoDocumento38 páginasEquilibrio QuimicoAnny CarolinaAinda não há avaliações
- Cromato e DicromatoDocumento9 páginasCromato e DicromatoWolney PiresAinda não há avaliações
- Equilibrio QuimicoDocumento32 páginasEquilibrio QuimicoJoseph AlvesAinda não há avaliações
- Equilíbrio Químico: Estudo das Reações ReversíveisDocumento10 páginasEquilíbrio Químico: Estudo das Reações ReversíveisJonacir NovaesAinda não há avaliações
- Equilíbrio Químico - Reacoes QuimicasDocumento29 páginasEquilíbrio Químico - Reacoes QuimicasDaniel ArrudaAinda não há avaliações
- Prof. Rafa - Química - Equilíbrio Químico - Prova P2 - 1 BimDocumento2 páginasProf. Rafa - Química - Equilíbrio Químico - Prova P2 - 1 BimRafael VaristeloAinda não há avaliações
- Equilíbrio QuímicoDocumento14 páginasEquilíbrio QuímicoCamila OliveiraAinda não há avaliações
- Equilíbrio Químico: Reações Reversíveis e Fatores que Alteram o SistemaDocumento6 páginasEquilíbrio Químico: Reações Reversíveis e Fatores que Alteram o SistemaEduarda SantannaAinda não há avaliações
- Equilíbrio Químico e Constante de Equilíbrio KcDocumento11 páginasEquilíbrio Químico e Constante de Equilíbrio KcMonica Elias100% (1)
- Química Analítica Qualitativa I (3a Aula Equilibrio) PDFDocumento37 páginasQuímica Analítica Qualitativa I (3a Aula Equilibrio) PDFJonatha SantosAinda não há avaliações
- 1) Equilibrio Quimico 1Documento7 páginas1) Equilibrio Quimico 1Luiz DantasAinda não há avaliações
- Química: Equilíbrio QuímicoDocumento21 páginasQuímica: Equilíbrio QuímicoRyaneAinda não há avaliações
- Equilíbrio QuímicoDocumento25 páginasEquilíbrio QuímicoMilkelison LavorAinda não há avaliações
- Apostila - Equlíbrio QuímicoDocumento2 páginasApostila - Equlíbrio QuímicoCamille SousaAinda não há avaliações
- Kc e Kp.docxDocumento3 páginasKc e Kp.docxbaptistajanicengolofiAinda não há avaliações
- Aula 2 Equilíbrio Químico - Solubilidade e Ácido-BaseDocumento61 páginasAula 2 Equilíbrio Químico - Solubilidade e Ácido-BaseAlex CotrimAinda não há avaliações
- Equilíbrio Químico e Homeostase emDocumento33 páginasEquilíbrio Químico e Homeostase emLeonardo Maciel100% (2)
- Material de Apoio-QcaDocumento14 páginasMaterial de Apoio-Qcaadolfoprimeiro56Ainda não há avaliações
- Aula 4 - FQ - Equilíbrio QuímicoDocumento10 páginasAula 4 - FQ - Equilíbrio QuímicojmessiasbrtAinda não há avaliações
- Equilíbrio Químico IDocumento6 páginasEquilíbrio Químico ITheCoguAinda não há avaliações
- Equilibrio QuimicoDocumento20 páginasEquilibrio QuimicoGiulliano Carlos ThomazAinda não há avaliações
- Equilíbrios Químicos HomogêneosDocumento19 páginasEquilíbrios Químicos HomogêneosDarllan R. BarrosAinda não há avaliações
- Equilíbrio Químico: Propriedades e Fatores que InfluenciamDocumento4 páginasEquilíbrio Químico: Propriedades e Fatores que Influenciamantonio josé das chagas100% (1)
- Quimica 12a Classe Ficha de ApoioDocumento8 páginasQuimica 12a Classe Ficha de ApoioDilva Nota100% (1)
- Equilíbrio químico e deslocamentoDocumento13 páginasEquilíbrio químico e deslocamentoNatel AmaralAinda não há avaliações
- Equilíbrio QuímicoDocumento4 páginasEquilíbrio QuímicoDiogo DiasAinda não há avaliações
- Constantes de Equilíbrio KC e Kp. Constantes de EquilíbrioDocumento2 páginasConstantes de Equilíbrio KC e Kp. Constantes de EquilíbrioNelson DomingosAinda não há avaliações
- Ficha de Apoio - Quimica - 12 Classe PDFDocumento8 páginasFicha de Apoio - Quimica - 12 Classe PDFPaulo Lewis100% (5)
- Equilíbrio Químico e Fatores que InfluenciamDocumento16 páginasEquilíbrio Químico e Fatores que InfluenciamMartinha LeãoAinda não há avaliações
- 013 Equil+¡brio Qu+¡mico MolecularDocumento25 páginas013 Equil+¡brio Qu+¡mico MolecularAlessandra ValençaAinda não há avaliações
- Aula 10 Equilibrio QuimicoDocumento11 páginasAula 10 Equilibrio QuimicoVinícius ViníciusAinda não há avaliações
- Apostila Equilíbrio Químico (1) ..Documento5 páginasApostila Equilíbrio Químico (1) ..goldminer2Ainda não há avaliações
- Biodiesel de Óleo de Babaçu por Destilação ReativaNo EverandBiodiesel de Óleo de Babaçu por Destilação ReativaAinda não há avaliações
- Amostras FecaisDocumento12 páginasAmostras FecaisRodrigo HoferAinda não há avaliações
- LAVADORA INDUSTRIAL E HOSPITALAR AUTOMÁTICADocumento2 páginasLAVADORA INDUSTRIAL E HOSPITALAR AUTOMÁTICAgimenAinda não há avaliações
- Roteiro do teste 1 da 2a série do ensino médioDocumento2 páginasRoteiro do teste 1 da 2a série do ensino médion/aAinda não há avaliações
- Proposta de Guia de Dissolução - 06.04.2018Documento36 páginasProposta de Guia de Dissolução - 06.04.2018Diego Guimaraes RibeiroAinda não há avaliações
- Esmalte Sintético Amarelo FISPQDocumento7 páginasEsmalte Sintético Amarelo FISPQErnilson NegrãoAinda não há avaliações
- Identificação e Separação Dos Cátions Mg2+, Ca2+, Sr2+ e Ba2+.Documento9 páginasIdentificação e Separação Dos Cátions Mg2+, Ca2+, Sr2+ e Ba2+.Gerlane GuedesAinda não há avaliações
- Spray Multibenefícios para Cabelos Lisos - FormulaçãoDocumento6 páginasSpray Multibenefícios para Cabelos Lisos - Formulaçãogabriel oliveira monteiroAinda não há avaliações
- NBR 7505-4 - Armazenagem de Produtos Inflamßveis e CombustÝveis - ProteþÒo Contra IncÛndioDocumento8 páginasNBR 7505-4 - Armazenagem de Produtos Inflamßveis e CombustÝveis - ProteþÒo Contra IncÛndioRicardo AkermanAinda não há avaliações
- Questoes FQ 2017 F1 PDFDocumento421 páginasQuestoes FQ 2017 F1 PDFaifa00100% (1)
- Exercícios Sobre Modelos AtômicosDocumento16 páginasExercícios Sobre Modelos AtômicosMarcio Navarro MartinsAinda não há avaliações
- 1 SolucoesDocumento93 páginas1 SolucoesGleison100% (1)
- Cinética Química - Objetivas - BásicoDocumento4 páginasCinética Química - Objetivas - BásicoLeonardo JacquesAinda não há avaliações
- Relatório de EletrostaticaDocumento12 páginasRelatório de EletrostaticapaulocezarAinda não há avaliações
- Recuperação de Ciências 9º AnoDocumento5 páginasRecuperação de Ciências 9º AnoMágdaSales0% (1)
- Determinação de açúcares em leite condensadoDocumento4 páginasDeterminação de açúcares em leite condensadoJessica Caroline VitóriaAinda não há avaliações
- Questões de Vestibulares IIDocumento8 páginasQuestões de Vestibulares IIFava6Ainda não há avaliações
- Nutrição No Esporte Diretrizes 3 Edição Asker JeukendrupDocumento1.453 páginasNutrição No Esporte Diretrizes 3 Edição Asker JeukendrupMatheus MaltaAinda não há avaliações
- Clorexidina na EndodontiaDocumento31 páginasClorexidina na EndodontiaJonasAraújo100% (1)
- Higiene na alimentação: exercícios práticosDocumento2 páginasHigiene na alimentação: exercícios práticosLeonardo AntonielleAinda não há avaliações
- Biopolímeros, Polímeros Biodegradáveis e Polímeros VerdesDocumento13 páginasBiopolímeros, Polímeros Biodegradáveis e Polímeros VerdesGuilherme FerreiraAinda não há avaliações
- CORR ARMAD CONCDocumento27 páginasCORR ARMAD CONCLilian Sokoloski100% (1)
- ResumoDocumento44 páginasResumoAnna Belly '-'Ainda não há avaliações
- EXPERIMENTOS DE QUÍMICA ATMOSFÉRICADocumento3 páginasEXPERIMENTOS DE QUÍMICA ATMOSFÉRICAFábio MoraisAinda não há avaliações
- Sintese Do Nitrobenzenoazo4Documento5 páginasSintese Do Nitrobenzenoazo4Samanta NóbregaAinda não há avaliações
- DZ 205Documento6 páginasDZ 205ahuahsAinda não há avaliações
- Tubos flexíveis PVC e PA6/PA6LDocumento21 páginasTubos flexíveis PVC e PA6/PA6LBruno DantasAinda não há avaliações
- Termodinâmica - QuímicaDocumento12 páginasTermodinâmica - QuímicaVinícius FulconiAinda não há avaliações
- Lista 02 - Aula 02-TCA-2020-IIDocumento5 páginasLista 02 - Aula 02-TCA-2020-IIjuninhu1919Ainda não há avaliações
- Sistema coloidal atmosféricoDocumento4 páginasSistema coloidal atmosféricoMiro AlbuquerqueAinda não há avaliações
- Lista de Exercícios Vários Vestibulares DilataçãoDocumento6 páginasLista de Exercícios Vários Vestibulares DilataçãoRenato AlAinda não há avaliações