Escolar Documentos
Profissional Documentos
Cultura Documentos
Resumo da Fosforilação Oxidativa
Enviado por
Rafaela de Jesus Oliveira0 notas0% acharam este documento útil (0 voto)
12 visualizações5 páginasTítulo original
12° Resumo
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
12 visualizações5 páginasResumo da Fosforilação Oxidativa
Enviado por
Rafaela de Jesus OliveiraDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 5
Resumo dos Tópicos 19.
1 a
19.4 do Capítulo 19
19.1 Reações de transferência de elétrons em
mitocôndrias
Ocorrem três tipos de transferência de elétrons
na fosforilação oxidativa: (1) transferência direta
de elétrons, como na redução de Fe3+ a Fe2+, (2)
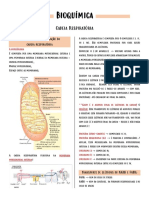
A matriz mitocondrial, delimitada pela transferência na forma de um átomo de
membrana interna, contém o complexo da hidrogênio (H+ + e-), e (3) transferência como um
piruvato-desidrogenase e as enzimas do ciclo íon hidreto (:H-), que tem dois elétrons. O termo
do ácido cítrico, a via de β-oxidação de ácidos equivalente redutor é usado para designar um
graxos e as vias de oxidação de aminoácidos – único elétron equivalente transferido em uma
todas as vias de oxidação de combustível, reação de oxidação-redução. Além do NAD e
exceto a glicólise, que ocorre no citosol. A das flavoproteínas, outros três tipos de
permeabilidade seletiva da membrana interna moléculas carregadoras de elétrons funcionam
segrega os intermediários e as enzimas das na cadeia respiratória: uma quinona hidrofóbica
vias metabólicas citosólicas daqueles dos (ubiquinona) e dois tipos diferentes de proteínas
processos metabólicos que ocorrem na matriz. que contêm ferro (citocromos e proteínas
No entanto, transportadores específicos ferro-enxofre). A ubiquinona (também chamada
carregam piruvato, ácidos graxos e de coenzima Q, ou simplesmente Q) é uma
aminoácidos ou seus a-cetoácidos derivados benzoquinona solúvel em lipídeos, com uma
para dentro da matriz, para acesso à longa cadeia lateral isoprenoide. Os compostos
maquinaria do ciclo do ácido cítrico. ADP e Pi intimamente relacionados, plastoquinona (de
são especificamente transportados para dentro cloroplastos vegetais) e menaquinona (de
da matriz quando ATP recém-sintetizado é bactérias) desempenham papéis análogos
transportado para fora. àquele da ubiquinona, carregando elétrons em
>> Os elétrons passam por uma série de cadeias de transferência de elétrons associadas
carregadores ligados à membrana a membranas. A ubiquinona pode aceitar um
A cadeia respiratória mitocondrial consiste em elétron para se tornar o radical semiquinona (*
uma série de carregadores que agem QH) ou dois elétrons para formar ubiquinol (QH2)
sequencialmente, sendo a maioria deles e, como os carregadores flavoproteínas, atuar na
proteínas integrais com grupos prostéticos junção entre um doador de dois elétrons e um
capazes de aceitar e doar um ou dois elétrons. aceptor de um elétron.
Os citocromos são proteínas com absorção
caracteristicamente forte de luz visível, devido
aos seus grupos prostéticos heme contendo
ferro. As mitocôndrias têm três classes de
citocromos, designados a, b e c, distinguidos
por diferenças em seus espectros de absorção
de luz. Cada tipo de citocromo em seu estado >> Os carregadores de elétrons atuam em
reduzido (Fe2+ ) tem três bandas de absorção complexos multienzimáticos
na faixa visível. A banda de comprimento de Complexo I: NADH à ubiquinona
onda mais longo é próxima de 600 nm em O complexo I, também chamado de NADH:
citocromos tipo a, próxima de 560 nm no tipo b ubiquinona-oxidorredutase ou
e perto de 550 nm no tipo c. Para distinguir NADH-desidrogenase, é uma enzima grande,
citocromos intimamente relacionados dentro de composta por 42 cadeias diferentes de
um determinado tipo, a absorção máxima exata polipeptídeos, incluindo uma flavoproteína
algumas vezes é utilizada nos nomes, como no contendo FMN e pelo menos seis centros de
citocromo b562.
ferro-enxofre. O complexo I tem formato de L,
com um braço do L na membrana e o outro se
estendendo para a matriz. O complexo I catalisa
dois processos simultâneos e obrigatoriamente
acoplados: (1) a transferência exergônica para a
ubiquinona de um íon hidreto do NADH e de um
próton da matriz, expressa por
NADH + H+ + Q → NAD+ + QH2
e (2) a transferência endergônica de quatro
prótons da matriz para o espaço intermembrana.
O complexo I é, portanto, um bombeador de
prótons que utiliza a energia da transferência de
elétrons, e a reação que ele catalisa é vetorial:
ela move prótons em uma direção específica de
um local (a matriz, que se torna negativamente
Em proteínas ferro-enxofre, o ferro está carregada com a saída dos prótons) a outro (o
ausente no heme, mas encontra-se em espaço intermembrana, que se torna
associação com átomos de enxofre positivamente carregado).
inorgânico, ou com átomos de enxofre dos
resíduos de Cys na proteína, ou com ambos.
Esses centros de ferro-enxofre (Fe-S) variam
de estruturas simples, com um único átomo
de Fe coordenado com quatro grupos
Cys-SH, a centros Fe-S mais complexos, com
dois ou quatro átomos de Fe. Proteínas ferro-
-enxofre de Rieske (denominadas em
homenagem a seu descobridor, John S.
Rieske) são uma variação nesse tema, onde
um átomo de Fe está combinado com dois
resíduos de His em vez de com resíduos de Complexo II: succinato a ubiquinona
Cys. Todas as proteínas ferro-enxofre Embora menor e mais simples do que o
participam de transferências de um elétron, complexo I, ele contém cinco grupos prostéticos
nas quais um átomo de ferro do aglomerado de dois tipos e quatro subunidades proteicas
ferro-enxofre é oxidado ou reduzido. diferentes. As subunidades C e D são proteínas
integrais de membrana, cada uma com três
hélices transmembrana. Elas contêm um grupo
heme, heme b, e um sítio de ligação para a
ubiquinona, o aceptor final de elétrons na reação
catalisada pelo complexo II. As subunidades A e
B se estendem para a matriz; elas contêm três
centros 2Fe-2S, FAD ligado e um sítio de ligação
para o substrato, o succinato. A via de
transferência de elétrons do sítio de ligação do
succinato a FAD e, então, pelos centros Fe-S
rumo ao sítio de ligação de Q, tem mais de 40 Å
de comprimento, mas nenhuma das distâncias
individuais de transferência de elétrons excede
cerca de 11 Å – distância razoável para uma
transferência rápida de elétrons.
Complexo IV: citocromo c para O2
Na etapa final da cadeia respiratória, o complexo
IV, também chamado de citocromo-oxidase,
carrega elétrons do citocromo c para o oxigênio
molecular, reduzindo-o a H2O. O complexo IV é
uma enzima grande (13 subunidades; Mr
204.000) da membrana mitocondrial interna. As
bactérias contêm uma forma bem mais simples,
com apenas três ou quatro subunidades, mas
ainda capaz de catalisar tanto a transferência de
elétrons quanto o bombeamento de prótons. A
comparação dos complexos mitocondrial e
Complexo III: ubiquinona para citocromo c
bacteriano sugere que três subunidades são
O complexo III, também chamado de complexo essenciais para a função.
de citocromo bc1 ou ubiquinona: citocromo
c-oxidorredutase, acopla a transferência de
elétrons do ubiquinol (QH2) para o citocromo c
com o transporte vetorial de prótons da matriz
para o espaço intermembrana. As
determinações da estrutura completa desse
enorme complexo e do complexo IV (a seguir)
por cristalografia por raios X, realizada entre
1995 e 1998, foram marcos no estudo da
transferência mitocondrial de elétrons,
fornecendo a base estrutural para integrar as
diversas observações bioquímicas das funções
dos complexos respiratórios.
A unidade funcional do complexo III é um
dímero, com as duas unidades monoméricas
de citocromo b circundando uma “caverna” no
>> A energia da transferência de elétrons
meio da membrana, na qual a ubiquinona fica
é eficazmente conservada em um gradiente
livre para se mover do lado da matriz da
de prótons
membrana (sítio QN em um monômero) para o
A transferência de dois elétrons do NADH, por
espaço intermembrana (sítio QP do outro
monômero), à medida que ela lança elétrons e meio da cadeia respiratória, para o oxigênio
prótons através da membrana mitocondrial molecular pode ser escrita como
interna. NADH + H+ + ½ O2 → NAD+ + H2O
Esta reação resultante é altamente exergônica.
Para o par redox NAD+/NADH, E’° é -0,320 V,
e, para o par O2/H2O, E’° é 0,816 V. O ΔE’° 19.2 Síntese de ATP
para esta reação é, portanto, 1,14 V, e a De que forma um gradiente de concentração de
variação na energia livre padrão é prótons se transforma em ATP? Foi visto que a
ΔG’° = -n ΔE’° transferência de elétrons libera e a força
= -2(96,5 kJ/V x mol) (1,14V) próton-motriz conserva energia livre mais do que
= -220kJ/mol (de NADH) suficiente (cerca de 200 kJ) por “mol” de par de
A maior parte dessa energia é usada para elétrons para impulsionar a formação de um mol
bombear prótons para fora da matriz. Para de ATP, que requer cerca de 50 kJ. Portanto, a
cada par de elétrons transferido para o O2, fosforilação oxidativa mitocondrial não impõe
quatro prótons são bombeados para fora pelo nenhum problema termodinâmico. Mas qual é o
complexo I, quatro pelo complexo III e dois pelo mecanismo químico que acopla o fluxo de
complexo IV. A equação vetorial para o prótons com a fosforilação? O modelo
processo é, portanto, quimiosmótico, proposto por Peter Mitchell, é o
NADH + 11HN+ + ½ O2→ NAD+ + 10HP+ + H20 paradigma para esse mecanismo.
>> Espécies reativas de oxigênio são
geradas durante a fosforilação oxidativa
Espécies reativas de oxigênio podem provocar
sérios danos, reagindo com enzimas, lipídeos
de membranas e ácidos nucleicos e os
danificando. Em mitocôndrias que respiram
ativamente, de 0,1 até 4% do oxigênio utilizado
na respiração formam • O-2 – mais do que
suficiente para ter efeitos letais, a não ser que De acordo com o modelo, a energia
o radical livre seja rapidamente descartado. eletroquímica inerente à diferença de
Fatores que diminuem a velocidade de fluxo de concentração de prótons e à separação de
elétrons pela cadeia respiratória aumentam a cargas através da membrana mitocondrial
formação de superóxido, talvez por interna – a força próton-motriz – impulsiona a
prolongarem o tempo de vida do • O-2 gerado síntese de ATP, à medida que os prótons fluem
no ciclo Q. A formação de ERO é favorecida passivamente de volta à matriz, por meio de
quando duas condições são satisfeitas: (a) as um poro para prótons na ATP-sintase.
mitocôndrias não estão produzindo ATP (por Quando mitocôndrias isoladas são suspensas
falta de ADP ou de O2) e, portanto, têm grande em um tampão contendo ADP, Pi e um
força próton-motriz e elevada razão QH2/Q e substrato oxidável como succinato, três
(b) e há uma alta razão NADH/NAD+ na matriz. processos facilmente mensuráveis ocorrem: (1)
Nessas situações, a mitocôndria está sob o substrato é oxidado (succinato produz
estresse oxidativo – há mais elétrons fumarato), (2) O2 é consumido e (3) ATP é
disponíveis para entrar na cadeia respiratória sintetizado. O consumo de oxigênio e a síntese
do que aquele número que pode de ATP dependem da presença de um
imediatamente atravessar até o oxigênio. substrato oxidável (nesse caso, o succinato),
Quando o suprimento de doadores de elétrons assim como de ADP e Pi. Uma vez que a
(NADH) é equiparado àquele de aceptores de energia da oxidação de substratos permite a
elétrons, existe menos estresse oxidativo e a síntese de ATP nas mitocôndrias, seria
produção de ERO é muito reduzida. Embora a esperado que os inibidores da passagem de
superprodução de ERO seja obviamente elétrons para o O2 (como cianeto, monóxido de
prejudicial, baixos níveis de ERO podem ser carbono e antimicina A) bloqueassem a síntese
usados pela célula como um sinal que reflete o de ATP. Mais surpreendente é o fato de que o
suprimento insuficiente de oxigênio (hipoxia), contrário também é verdadeiro: a inibição da
desencadeando ajustes metabólicos. síntese de ATP bloqueia a transferência de
elétrons em mitocôndrias intactas. Esse
acoplamento obrigatório pode ser demonstrado da oxidação de cada um dos aminoácidos.
em mitocôndrias isoladas, fornecendo-se O2 e Portanto, as vias oxidativas aeróbias que
substratos oxidáveis, mas não ADP. Nessas resultam na transferência de elétrons ao O2
condições, nenhuma síntese de ATP pode acompanhada da fosforilação oxidativa são
ocorrer, e a transferência de elétrons para o O2 responsáveis pela grande maioria do ATP
não prossegue. produzido no catabolismo, de forma que é
>>A ATP-sintase tem dois domínios absolutamente essencial a regulação da
funcionais, Fo e F1 produção de ATP pela fosforilação oxidativa,
A ATP-sintase, também chamada de complexo para se ajustar às necessidades celulares
V, tem dois componentes distintos: F1, proteína flutuantes da demanda por ATP.
periférica de membrana, e Fo (o indicando >> A hipoxia leva à produção de ERO e a
sensível à oligomicina), integral à membrana. várias respostas adaptativas
F1, o primeiro fator reconhecido como essencial Em células hipóxicas, existe um desequilíbrio
para a fosforilação oxidativa, foi identificado e entre a chegada de elétrons a partir da oxidação
purificado por Efraim Racker e colaboradores de combustíveis celulares na matriz mitocondrial e
no começo da década de 1960. a transferência de elétrons para o oxigênio
Quando F1 é gentilmente extraído, as vesículas molecular, levando a uma maior formação de
“desnudas” ainda contêm cadeias respiratórias espécies reativas de oxigênio. Além do sistema
intactas e a porção Fo da ATP-sintase. As da glutationa-peroxidase, as células têm outras
vesículas podem catalisar a transferência de duas linhas de defesa contra as ERO. Uma é a
elétrons do NADH ao O2, mas não podem regulação da piruvato-desidrogenase (PDH), a
produzir um gradiente de prótons: Fo tem um enzima que fornece acetil-CoA ao ciclo do ácido
poro para prótons por meio do qual os prótons cítrico. A segunda maneira de impedir a formação
vazam tão rapidamente quanto são bombeados de ERO é a substituição de uma subunidade do
pela transferência de elétrons, e sem um complexo IV, conhecida como COX4-1, por outra
gradiente de prótons as vesículas desprovidas subunidade, COX4-2, que é melhor ajustada a
de F1 não podem produzir ATP. O F1 isolado condições hipóxicas. Com COX4-1, as
catalisa a hidrólise de ATP (o reverso da propriedades catalíticas do complexo IV são
síntese), sendo, portanto, originalmente ótimas para a respiração em concentrações
chamado de F1-ATPase. Quando F1 purificado normais de oxigênio; com COX4-2, o complexo IV
é adicionado de volta às vesículas, ele se é otimizado para operar sob condições hipóxicas.
associa novamente com Fo, fechando seu poro
de prótons e restaurando a capacidade da >> As vias produtoras de ATP são
membrana de acoplar a transferência de coordenadamente reguladas
elétrons à síntese de ATP. As concentrações relativas de ATP e ADP
controlam não somente as taxas de transferência
19.3 Regulação da fosforilação oxidativa de elétrons e a fosforilação oxidativa, mas
A fosforilação oxidativa produz a maior parte do também as velocidades do ciclo do ácido cítrico,
ATP fabricado em células aeróbias. A oxidação da oxidação do piruvato e da glicólise. Sempre
completa de uma molécula de glicose a CO2 que o consumo de ATP aumenta, as velocidades
produz 30 ou 32 ATP. Em comparação, a da cadeia transportadora de elétrons e da
glicólise sob condições anaeróbias fosforilação oxidativa aumentam.
(fermentação láctica) gera apenas dois ATP por Simultaneamente, a velocidade de oxidação do
glicose. Claramente, a evolução da fosforilação piruvato pelo ciclo do ácido cítrico aumenta,
oxidativa proporcionou um grande aumento na elevando o fluxo de elétrons na cadeia
eficiência energética do catabolismo. A respiratória. Esses eventos podem, por sua vez,
oxidação completa até CO2 do derivado do evocar um aumento na velocidade da glicólise,
palmitato (16:0) ligado à coenzima A, que aumentando a velocidade de formação de
também ocorre na matriz mitocondrial, produz piruvato. Quando a conversão de ADP em ATP
108 ATP por palmitoil-CoA. Um cálculo similar reduz a concentração de ADP, o controle pelo
pode ser feito para a produção de ATP a partir aceptor diminui a transferência de elétrons e,
assim, a fosforilação oxidativa.
Você também pode gostar
- Fosforilação OxidativaDocumento78 páginasFosforilação Oxidativamellogenilza88Ainda não há avaliações
- Lista Cadeia Transportadora de Eletrons e Fosforilação OxidativaDocumento7 páginasLista Cadeia Transportadora de Eletrons e Fosforilação OxidativaGuilherme Belak SchmitkeAinda não há avaliações
- Fosforilação OxidativaDocumento36 páginasFosforilação OxidativaDhébora Albuquerque DiasAinda não há avaliações
- Cadeia Transportadora de Elétrons: Fundamentos e Mecanismo da Fosforilação OxidativaDocumento26 páginasCadeia Transportadora de Elétrons: Fundamentos e Mecanismo da Fosforilação OxidativaViviane RangelAinda não há avaliações
- Cadeia Transportadora e Fosforilação Oxidativa Retificada-1Documento1 páginaCadeia Transportadora e Fosforilação Oxidativa Retificada-1JohanaAinda não há avaliações
- Ciclo de Krebs, cadeia respiratória e fosforilação oxidativaDocumento3 páginasCiclo de Krebs, cadeia respiratória e fosforilação oxidativaadelsonribeiro100% (2)
- Cadeia RespiratóriaDocumento4 páginasCadeia RespiratóriaAndré Duarte CanellasAinda não há avaliações
- Aula 09 - Fosforilação OxidativaDocumento7 páginasAula 09 - Fosforilação OxidativaMarcela Lima de BritoAinda não há avaliações
- White and Purple Doodle Mind Map BrainstormDocumento1 páginaWhite and Purple Doodle Mind Map BrainstormAmanda LisboaAinda não há avaliações
- SlidesCadeiaTransportadoraDeEletronsDocumento12 páginasSlidesCadeiaTransportadoraDeEletronscelsogdjAinda não há avaliações
- Fosforilação oxidativa: transferência de elétrons na cadeia respiratóriaDocumento32 páginasFosforilação oxidativa: transferência de elétrons na cadeia respiratóriaEveny PereiraAinda não há avaliações
- CTE e Fosf OxidativaDocumento27 páginasCTE e Fosf OxidativaJosimar JúniorAinda não há avaliações
- Complexo IDocumento3 páginasComplexo IGrazielaAinda não há avaliações
- Cadeia Transportadora de ElétronsDocumento1 páginaCadeia Transportadora de ElétronsElisa CamposAinda não há avaliações
- Fosforilação OxidativaDocumento31 páginasFosforilação Oxidativatitalves100% (1)
- Transporte de elétrons na cadeia respiratóriaDocumento15 páginasTransporte de elétrons na cadeia respiratóriaSGI Gestão IntegradoAinda não há avaliações
- Visão Geral Da Fosforilação OxidativaDocumento6 páginasVisão Geral Da Fosforilação OxidativaAna Paula AzevedoAinda não há avaliações
- Cadeia RespiratóriaDocumento60 páginasCadeia RespiratóriaAlline RodriguesAinda não há avaliações
- Cadeia respiratória: transporte de elétrons e formação de ATPDocumento15 páginasCadeia respiratória: transporte de elétrons e formação de ATPTayanni LucenaAinda não há avaliações
- Fosforilação oxidativaDocumento36 páginasFosforilação oxidativaCatharina GuimarãesAinda não há avaliações
- Conferencia 16 La Cadena de Transporte de Electrones PORTUGUESDocumento35 páginasConferencia 16 La Cadena de Transporte de Electrones PORTUGUESJoaquim JosephAinda não há avaliações
- 20210412-Cadeia Respiratória (Fosforilação Oxidativa) - ADocumento11 páginas20210412-Cadeia Respiratória (Fosforilação Oxidativa) - AISABELA TEIXEIRA DE FREITASAinda não há avaliações
- Fosforilação oxidativa: síntese de ATPDocumento4 páginasFosforilação oxidativa: síntese de ATPRamires Cerqueira100% (1)
- Cadeia Transporte Elétrons Fosforilação OxidativaDocumento48 páginasCadeia Transporte Elétrons Fosforilação OxidativaDiesSyca Masson MassonzinhaAinda não há avaliações
- Fosforilação oxidativa: síntese de ATP na mitocôndriaDocumento23 páginasFosforilação oxidativa: síntese de ATP na mitocôndriaAntonio Carlos Silva-JúniorAinda não há avaliações
- Slides Aula 11. CTE e Fosforilação OxidativaDocumento26 páginasSlides Aula 11. CTE e Fosforilação OxidativaÂngelo AbnerAinda não há avaliações
- RESUMO prova biocelularDocumento20 páginasRESUMO prova biocelularguiarensoAinda não há avaliações
- Fotossíntese em plantas: fluxo de elétronsDocumento27 páginasFotossíntese em plantas: fluxo de elétronswalas joãoAinda não há avaliações
- Membranas e transporte: tipos e mecanismosDocumento6 páginasMembranas e transporte: tipos e mecanismosSheila PinhoAinda não há avaliações
- Slides Cadeia Transportadora de EletronsDocumento14 páginasSlides Cadeia Transportadora de EletronscelsogdjAinda não há avaliações
- Fosforolização OxidativaDocumento16 páginasFosforolização Oxidativabrunowarley1982Ainda não há avaliações
- Processos MitocondriaisDocumento8 páginasProcessos MitocondriaisLone GhostAinda não há avaliações
- Estudo Dirigido - Mitocôndrias e Cloroplastos.Documento3 páginasEstudo Dirigido - Mitocôndrias e Cloroplastos.Luiza LopesAinda não há avaliações
- Síntese ATP via cadeia transporte elétronsDocumento4 páginasSíntese ATP via cadeia transporte elétronsRamires CerqueiraAinda não há avaliações
- Cadeia Transportadora de ElétronsDocumento2 páginasCadeia Transportadora de ElétronsDhara GabriellaAinda não há avaliações
- Fosforilação Oxidativa e Fotofosforilação: Processos de Conversão de Energia BiológicaDocumento86 páginasFosforilação Oxidativa e Fotofosforilação: Processos de Conversão de Energia BiológicaLeticia LopesAinda não há avaliações
- AULA 1 - Respiração CelularDocumento75 páginasAULA 1 - Respiração CelularWilliams Fabi KawanyAinda não há avaliações
- Respostas BioqDocumento9 páginasRespostas BioqcccaiotestecesarAinda não há avaliações
- Fosforilação oxidativa: cadeia transportadora de elétrons e síntese de ATPDocumento24 páginasFosforilação oxidativa: cadeia transportadora de elétrons e síntese de ATPLucas Roniery100% (1)
- Estudo P2 - BioquímicaDocumento20 páginasEstudo P2 - BioquímicaMirella FrancoAinda não há avaliações
- Biofísica Das Membranas BiológicasDocumento23 páginasBiofísica Das Membranas BiológicasAlexandre Bastos Gomide50% (2)
- Formação de Atp Nas MitocondriasDocumento2 páginasFormação de Atp Nas MitocondriasThalitaAinda não há avaliações
- 004 Aula Semana 4Documento37 páginas004 Aula Semana 4Gabriella S. de SouzaAinda não há avaliações
- Reações fotoquímicas na fotossínteseDocumento11 páginasReações fotoquímicas na fotossínteseDário Cristovão CristovãoAinda não há avaliações
- (Alberts, 4 Ed) Cap. 14 - Geração de Energia Nas MitocôndriasDocumento8 páginas(Alberts, 4 Ed) Cap. 14 - Geração de Energia Nas MitocôndriasDenis NascimentoAinda não há avaliações
- Cadeia Transportadora de ElétronsDocumento3 páginasCadeia Transportadora de ElétronsMaria Eduarda DiasAinda não há avaliações
- Estudo Dirigido - ClotoplastosDocumento3 páginasEstudo Dirigido - ClotoplastosLuiza LopesAinda não há avaliações
- Transporte de Solutos Através Das Membranas CelularesDocumento38 páginasTransporte de Solutos Através Das Membranas CelularesKim Kishi SenaAinda não há avaliações
- Fosforilacao Oxidativa - PerguntasDocumento4 páginasFosforilacao Oxidativa - PerguntasSara Sampaio50% (2)
- Lista Eletricidade Biofísica Membrana ResolvidaDocumento5 páginasLista Eletricidade Biofísica Membrana ResolvidaatividadesmarciaAinda não há avaliações
- Resumo - Cadeia de Transporte de Elétrons e Fosforilação OxidativaDocumento5 páginasResumo - Cadeia de Transporte de Elétrons e Fosforilação OxidativaLAIS VERONEZ MARQUES BARROSAinda não há avaliações
- Aula 2. Fotoautotrofia (Reacoes Dependentes Da Luz) - CopiaDocumento24 páginasAula 2. Fotoautotrofia (Reacoes Dependentes Da Luz) - CopiaCAPAINA BENCILARIO ANDRE FAinda não há avaliações
- Exercicios Terceiro ModuloDocumento3 páginasExercicios Terceiro ModuloGabriela AndradeAinda não há avaliações
- 3 Lista Qumica2 Profqui Carla LarissaDocumento2 páginas3 Lista Qumica2 Profqui Carla LarissaLarissa LimaAinda não há avaliações
- A Fosforilação Oxidativa na MitocôndriaDocumento59 páginasA Fosforilação Oxidativa na MitocôndriaLuah CamargoAinda não há avaliações
- Estudo Dirigido - Transporte Através de Membranas CelularesDocumento2 páginasEstudo Dirigido - Transporte Através de Membranas CelularesLuiza LopesAinda não há avaliações
- Resumo BioquA - Mica II - P2Documento21 páginasResumo BioquA - Mica II - P2Caroline Carvalho LimaAinda não há avaliações
- A Cadeia de Transporte de ElétronsDocumento8 páginasA Cadeia de Transporte de ElétronsSamilly BarbosaAinda não há avaliações
- Correcção Das Perguntas de BiologiaDocumento4 páginasCorrecção Das Perguntas de BiologiaTomás D'Azevedo LopesAinda não há avaliações
- RESUMO VII - Rafaela de Jesus OliveiraDocumento5 páginasRESUMO VII - Rafaela de Jesus OliveiraRafaela de Jesus OliveiraAinda não há avaliações
- Resumo dos processos fotoquímicos e de fixação de carbono na fotossínteseDocumento5 páginasResumo dos processos fotoquímicos e de fixação de carbono na fotossínteseRafaela de Jesus OliveiraAinda não há avaliações
- Resumo XIDocumento10 páginasResumo XIRafaela de Jesus OliveiraAinda não há avaliações
- Desenvolvimento de Materiais DidáticosDocumento5 páginasDesenvolvimento de Materiais DidáticosRafaela de Jesus OliveiraAinda não há avaliações
- Apnp 02 - Introdução A Recursos HumanosDocumento3 páginasApnp 02 - Introdução A Recursos HumanosPedro TheodoroAinda não há avaliações
- EletromagnetismoDocumento12 páginasEletromagnetismoMariana Dolores de OliveiraAinda não há avaliações
- Notas do Kindle sobre o livro Sem Data Venia de Luís Roberto BarrosoDocumento19 páginasNotas do Kindle sobre o livro Sem Data Venia de Luís Roberto BarrosotheuanAinda não há avaliações
- Ciac - Instituto Incluso - ResumoDocumento1 páginaCiac - Instituto Incluso - ResumoGeovane VianaAinda não há avaliações
- Ossos Músculos e ArticulaçõesDocumento8 páginasOssos Músculos e ArticulaçõesRaquel CorrêaAinda não há avaliações
- Perfil Hematologico de Psitacideos ExóticosDocumento10 páginasPerfil Hematologico de Psitacideos ExóticosCarlos Diego Sousa RibeiroAinda não há avaliações
- Manual CNC FagorDocumento80 páginasManual CNC FagorBernardo BatistaAinda não há avaliações
- Ficha de Anamnese MariaAyahuasca PDFDocumento3 páginasFicha de Anamnese MariaAyahuasca PDFLEANDRO NEGRETTIAinda não há avaliações
- Meliopolicultura para Recuperação Da Mata Atlântica No Estado Do Rio de JaneiroDocumento7 páginasMeliopolicultura para Recuperação Da Mata Atlântica No Estado Do Rio de JaneiroAsetyDrawingsAinda não há avaliações
- 003 12-Rules-to-Learn-to-Code-eBook-Copyright-App-Brewery - En.ptDocumento35 páginas003 12-Rules-to-Learn-to-Code-eBook-Copyright-App-Brewery - En.ptFrederico MacauAinda não há avaliações
- Reconquistar Ex-NamoradaDocumento7 páginasReconquistar Ex-Namoradatiago.carneiroferreiraAinda não há avaliações
- Universidade Federal de Goiás-Campus CatalãoDocumento6 páginasUniversidade Federal de Goiás-Campus Catalãoclires raueile da rocha nascimentoAinda não há avaliações
- Estudo Dirigido Membrana e Transporte A DistânciaDocumento2 páginasEstudo Dirigido Membrana e Transporte A DistânciaCleber VieiraAinda não há avaliações
- O racionalismo de Descartes e o empirismo de HumeDocumento8 páginasO racionalismo de Descartes e o empirismo de HumeLittle FlowerAinda não há avaliações
- Transformação Linear - Exercício ResolvidoDocumento1 páginaTransformação Linear - Exercício ResolvidoTiago PimentaAinda não há avaliações
- Credenciamento de empresas de mergulho no Porto de SantosDocumento7 páginasCredenciamento de empresas de mergulho no Porto de SantosVanessa ThomazAinda não há avaliações
- 4 - Unidade 2 - O Uso Da Sociologia em Diversos Campos Da Atividade HumanaDocumento5 páginas4 - Unidade 2 - O Uso Da Sociologia em Diversos Campos Da Atividade HumanaGustavo Victor Silva NunesAinda não há avaliações
- Determinação da viscosidade de produtos de petróleo com aparelho de banho termostatadoDocumento13 páginasDeterminação da viscosidade de produtos de petróleo com aparelho de banho termostatadoisaaq MAinda não há avaliações
- Circuitos pneumáticos industriaisDocumento8 páginasCircuitos pneumáticos industriaisaida.unbAinda não há avaliações
- Texto - O Papel Da Didática Na Formação Do EducacorDocumento6 páginasTexto - O Papel Da Didática Na Formação Do EducacorPriscila Carvalho0% (1)
- Histórias indígenas que revelam sua sabedoria ancestralDocumento15 páginasHistórias indígenas que revelam sua sabedoria ancestralAline Irisnã AlmeidaAinda não há avaliações
- Fispq - Limpa Vidros PowerDocumento7 páginasFispq - Limpa Vidros PowerFlavio Furtuoso RoqueAinda não há avaliações
- Calculo de Calor - Cozinha - 2022Documento1 páginaCalculo de Calor - Cozinha - 2022marcio2626260% (1)
- Resumo Aula 01 - Introdução e Temas GeraisDocumento45 páginasResumo Aula 01 - Introdução e Temas GeraisJÉSSICA NascimentoAinda não há avaliações
- Questões ProvãoDocumento2 páginasQuestões ProvãoSimone Gomes OliveiraAinda não há avaliações
- Preparacao para o Exame de BCMDocumento46 páginasPreparacao para o Exame de BCMDania Bai MarcetaAinda não há avaliações
- Elementos da linguagem visualDocumento7 páginasElementos da linguagem visualMaria NascimentoAinda não há avaliações
- The Chronology of Water A MemoirDocumento220 páginasThe Chronology of Water A Memoirjb.ortizrodriguesAinda não há avaliações
- O Cérebro Emocional PDFDocumento297 páginasO Cérebro Emocional PDFmarcosmind94% (16)
- Teoria Do Orbital Molecular: Orbitais Nas MoléculasDocumento32 páginasTeoria Do Orbital Molecular: Orbitais Nas MoléculasMahira AdnaAinda não há avaliações