Escolar Documentos
Profissional Documentos
Cultura Documentos
Aula 4 Peptdeos
Enviado por
PCris Alves0 notas0% acharam este documento útil (0 voto)
6 visualizações7 páginasTítulo original
Aula_4_Peptdeos
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
6 visualizações7 páginasAula 4 Peptdeos
Enviado por
PCris AlvesDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 7
Aula 4: Peptídeos
PROFª MED VET BRUNA MARTINS MOTA
INTRODUÇÃO
• Variam em tamanho (2-3 a
milhares de resíduos de aa
ligados)
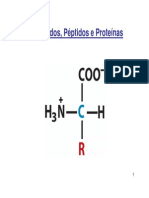
• Ligações peptídicas
- Desidratação e condensação
- Dipeptídeos, tripeptídeos...
- Oligopeptídeo, polipeptídeo
(massa < 10.000) Resíduo:
- Proteínas: Milhares - Aminoterminal (N-terminal)
- Carboxiterminal (C-terminal)
INTRODUÇÃO
Hidrólise da ligação peptídica é exergônica, mas
requer alta energia de ativação
- Maior estabilidade
IONIZAÇÃO
• Pka diferente
• Grupos R podem se ionizar
• Possuem curvas de titulação e pI
- Resíduo ≠ aa
TAMANHO E COMPOSIÇÃO
• Hormônios: pequenos peptídeos
Ex: ocitocina (9aa)
• Titina (26.926aa)
❑As proteínas podem ter mais de 1 cadeia polipeptídica (proteínas
multissubunidade)
- Mínimo 2 cadeias iguais = proteína oligomérica, com seus protômeros
Ex: Hemoglobina => 2 cadeias α e 2 cadeias β, pareadas α-β
TAMANHO E COMPOSIÇÃO
• Se a ligação for covalente, são chamados de cadeias
Ex: ligações dissulfeto na insulina
• Os aa variam na quantidade (e ordem) em que aparece na proteína – estrutura e
função
• O nº de resíduos de aa na proteína pode ser calculado, dividindo a massa
molecular por 110
Outros Grupos
• Proteína simples
Ex: Ribonuclease A
• Proteína conjugada
- Grupo prostéticos (função biológica)
Ex: Lipoproteínas, metaloproteínas
Você também pode gostar
- 03 Peptideos (2 Por Pagina)Documento7 páginas03 Peptideos (2 Por Pagina)Stella Indiukov dos SantosAinda não há avaliações
- Resumo Proteínas e PeptídeosDocumento6 páginasResumo Proteínas e PeptídeosHeloisa Moreira Dias PereiraAinda não há avaliações
- 03 Peptideos (6 Por Pagina)Documento3 páginas03 Peptideos (6 Por Pagina)Stella Indiukov dos SantosAinda não há avaliações
- O Que São MacronutrintesDocumento4 páginasO Que São Macronutrintesloane sampaioAinda não há avaliações
- Aminoácidos e ProteínasDocumento57 páginasAminoácidos e Proteínasraphael.pintoAinda não há avaliações
- A 3 - Aminoácidos e ProteínasDocumento96 páginasA 3 - Aminoácidos e Proteínasmarconi alvesAinda não há avaliações
- Protein AsDocumento63 páginasProtein AsSteicy MorgadoAinda não há avaliações
- 2aula Aminoacidos (Modo de Compatibilidade)Documento38 páginas2aula Aminoacidos (Modo de Compatibilidade)Elizael De Jesus GonçalvesAinda não há avaliações
- Aula 6 Moléculas Da Vida - MacromoleculasDocumento69 páginasAula 6 Moléculas Da Vida - Macromoleculasclbprojeto02Ainda não há avaliações
- Resumo P1 BioquimicaDocumento5 páginasResumo P1 BioquimicaDarkness mindAinda não há avaliações
- Aula 3 - Organizao Molecular Das Clulas 2022Documento25 páginasAula 3 - Organizao Molecular Das Clulas 2022LUANA SILVAAinda não há avaliações
- Ciclo de KrebsDocumento8 páginasCiclo de Krebsdielen23100% (1)
- Peptídios & ProteínasDocumento50 páginasPeptídios & ProteínasAdriano RomaniniAinda não há avaliações
- Bioquímica - Aminoácidos e PeptídeosDocumento7 páginasBioquímica - Aminoácidos e PeptídeosCayê AlvesAinda não há avaliações
- Estudo DirigidoDocumento16 páginasEstudo DirigidoRenatoMatias100% (2)
- Aula ProteinasDocumento15 páginasAula ProteinasSocorro Alencar AlencarAinda não há avaliações
- Ch03 Lehninger8 2021Documento35 páginasCh03 Lehninger8 2021bolotatiagoAinda não há avaliações
- Aula 9 - Aminoácidos, Peptídeos e ProteínasDocumento45 páginasAula 9 - Aminoácidos, Peptídeos e ProteínasLucas BatistaAinda não há avaliações
- Proteínas e Enzimas Iberê Catolica-1Documento42 páginasProteínas e Enzimas Iberê Catolica-1Anderson R. de OliveiraAinda não há avaliações
- Aula 7 - Metabolismo de Proteínas No ExercícioDocumento86 páginasAula 7 - Metabolismo de Proteínas No ExercícioJuca Pirama100% (1)
- Aula 02 - Composição Molecular Das Células - 1 SlideDocumento44 páginasAula 02 - Composição Molecular Das Células - 1 SlideDouglas SouzaAinda não há avaliações
- File 2Documento44 páginasFile 2Gustavo Vieira RennóAinda não há avaliações
- Fosforilação Oxidativa e Cadeia Transportadora de ElétronsDocumento42 páginasFosforilação Oxidativa e Cadeia Transportadora de ElétronsFernando BritoAinda não há avaliações
- ESTUDO DIRIGIDO GabaritoDocumento5 páginasESTUDO DIRIGIDO GabaritoKascio CarangolaAinda não há avaliações
- Aminoácidos Peptidos e ProteínasDocumento96 páginasAminoácidos Peptidos e ProteínasJoana LeãoAinda não há avaliações
- Aminoacidos 2019Documento41 páginasAminoacidos 20195tptk7thhzAinda não há avaliações
- Informativa BiomoléculasDocumento4 páginasInformativa BiomoléculasJoséJoaquimTeixeiraAinda não há avaliações
- Aula 2 - Aminoácidos Pepetídeos e ProteínasDocumento51 páginasAula 2 - Aminoácidos Pepetídeos e ProteínasviniciusAinda não há avaliações
- Aula 13Documento36 páginasAula 13Nuno G. PintoAinda não há avaliações
- Resumo BGDocumento9 páginasResumo BGafonseldinisAinda não há avaliações
- Biomoléculas - Biologia 10ºanoDocumento4 páginasBiomoléculas - Biologia 10ºanoJoanaAinda não há avaliações
- Aminoácidos e ProteínasDocumento51 páginasAminoácidos e Proteínasmiqueiasgomes100% (2)
- Semana 8 - ProteinasDocumento16 páginasSemana 8 - ProteinasElizabethCristinaAinda não há avaliações
- Aula 5-Aminoacidos Peptideos e Proteã NasDocumento33 páginasAula 5-Aminoacidos Peptideos e Proteã NasGilkeciaPiresAinda não há avaliações
- Protein AsDocumento35 páginasProtein AsTaynna MariaAinda não há avaliações
- ProteínasDocumento78 páginasProteínasIsabella Carvalho Vasconcelos da RochaAinda não há avaliações
- Aula 2 - Biologia CelularcontDocumento22 páginasAula 2 - Biologia CelularcontcleidefersilvaAinda não há avaliações
- BioQ - NP1Documento17 páginasBioQ - NP1VICTOR GAMEPLAY'SAinda não há avaliações
- Edil Q O Teórica - Aula Unidade 2Documento94 páginasEdil Q O Teórica - Aula Unidade 2leticia trindadeAinda não há avaliações
- Aula 5 - PROTENAS EstruturaDocumento22 páginasAula 5 - PROTENAS EstruturaPCris AlvesAinda não há avaliações
- Bioquímica - Respiração CelularDocumento118 páginasBioquímica - Respiração CelularSávio EmanuelAinda não há avaliações
- Compostos Organicos 1Documento6 páginasCompostos Organicos 1Ester ZylbersztejnAinda não há avaliações
- Iiunid Cap 2 Top 3 e 4 9 Ano OkDocumento25 páginasIiunid Cap 2 Top 3 e 4 9 Ano OkanaluizagomesdelimaesilvaAinda não há avaliações
- Aula 4 - Aa. e ProteínasDocumento36 páginasAula 4 - Aa. e ProteínasCanal Oseias e PrimosAinda não há avaliações
- AminoácidosDocumento53 páginasAminoácidosmonekobeAinda não há avaliações
- Aula01BioqII BioenergéticaDocumento40 páginasAula01BioqII BioenergéticaGustavo Daltio MoraesAinda não há avaliações
- 21022019163425bioquímica - Aminoácidos, Peptídeos e Proteínas PDFDocumento24 páginas21022019163425bioquímica - Aminoácidos, Peptídeos e Proteínas PDFmaites miguelAinda não há avaliações
- Lipídios AulaDocumento38 páginasLipídios AulaBernadete AraújoAinda não há avaliações
- Gasto 2° TutoriaDocumento9 páginasGasto 2° TutoriaPedro Henrique Almeida de BritoAinda não há avaliações
- ProteínasDocumento29 páginasProteínasmaites miguelAinda não há avaliações
- Aminoácidos ProteínasDocumento16 páginasAminoácidos ProteínasGleense CartonilhoAinda não há avaliações
- Aula 2 - Peptídeos e Proteínas (Introdução)Documento49 páginasAula 2 - Peptídeos e Proteínas (Introdução)amandacutzewAinda não há avaliações
- Metabolismo de Proteínas PDFDocumento15 páginasMetabolismo de Proteínas PDFJandderson CostaAinda não há avaliações
- 3BIOMOLÉCULAS I - Água, Prótidos, GlícidosDocumento37 páginas3BIOMOLÉCULAS I - Água, Prótidos, Glícidosvidawo1012Ainda não há avaliações
- Proteínas e EnzimasDocumento8 páginasProteínas e EnzimasVitória MendesAinda não há avaliações
- Aula ProteínasDocumento25 páginasAula ProteínasAndré SilvaAinda não há avaliações
- Quadro Síntese BiomoléculasDocumento3 páginasQuadro Síntese BiomoléculasMarisa SilvaAinda não há avaliações
- Caderno de Apoio Às Aulas Teóricas 1 Apontamentos PDFDocumento113 páginasCaderno de Apoio Às Aulas Teóricas 1 Apontamentos PDFFCiênciasAinda não há avaliações
- Aula 5 ProtenasDocumento12 páginasAula 5 ProtenasPCris AlvesAinda não há avaliações
- Tcnica HistopatolgicaDocumento34 páginasTcnica HistopatolgicaPCris AlvesAinda não há avaliações
- 11 - Morfologia Microscpica Do Sistema Genital Feminino Dos Animais DomsticosDocumento67 páginas11 - Morfologia Microscpica Do Sistema Genital Feminino Dos Animais DomsticosPCris AlvesAinda não há avaliações
- Manual Saúde de Ferro - Programa Nacional de Suplementação de FerroDocumento32 páginasManual Saúde de Ferro - Programa Nacional de Suplementação de FerroEdnéia De Sousa AraujoAinda não há avaliações
- Aula 2 CiclosAv Dietetica e InqueritosDocumento54 páginasAula 2 CiclosAv Dietetica e InqueritosPCris AlvesAinda não há avaliações
- Bpsa 2Documento20 páginasBpsa 2PCris AlvesAinda não há avaliações
- Cetam - Introdução A Nutrição - Modulo 1 PDFDocumento13 páginasCetam - Introdução A Nutrição - Modulo 1 PDFPCris AlvesAinda não há avaliações
- Normas VancouverDocumento13 páginasNormas VancouverPCris AlvesAinda não há avaliações