Escolar Documentos
Profissional Documentos
Cultura Documentos
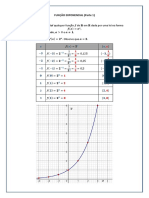
Física Estatística: Exercício 3 - Capítulo I
Enviado por
João SenaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Física Estatística: Exercício 3 - Capítulo I
Enviado por
João SenaDireitos autorais:
Formatos disponíveis
𝜕𝑆
Física Estatística 𝐶𝑉 = 𝑇 (𝜕𝑇 )𝑉 e tentar encontrar 𝐶𝑃 pelo caminho. Assim sendo,
precisamos de fazer aparecer a pressão nos cálculos e de nos livrar da
Exercício 3 – capítulo I entropia, sempre que conveniente (𝐶𝑃 = 𝑇 (𝜕𝑇𝜕𝑆
)𝑃 ). Para isso podemos
Alexandre André (N.º 54510) recorrer às propriedades do Jacobiano e a uma relação de Maxwell
(demonstradas em exercícios anteriores).
A partir das fórmulas para as capacidades caloríficas
Nota: podíamos ter partido de 𝐶𝑃 em vez de 𝐶𝑉 (left as an exercise to
𝜕𝑈 𝜕𝐻 the reader 😉)!
𝐶𝑉 = ( ) e 𝐶𝑃 = ( )
𝜕𝑇 𝑉 𝜕𝑇 𝑃
deduza que Como
2 𝜕𝑢 𝜕(𝑢, 𝑦)
𝜕𝑆 𝜕𝑆 (𝜕𝑉 ) ( ) =
𝜕𝑥 𝑦 𝜕(𝑥, 𝑦)
𝜕𝑇 𝑃
𝐶𝑉 = 𝑇 ( ) , 𝐶𝑃 = 𝑇 ( ) e 𝐶𝑃 − 𝐶𝑉 = −𝑇 .
𝜕𝑇 𝑉 𝜕𝑇 𝑃 (𝜕𝑉 )
𝜕𝑃 𝑇
tomando 𝑢 = 𝑆, 𝑥 = 𝑇 e 𝑦 = 𝑉 temos
Uma vez que (∂𝑉 / ∂𝑃 )𝑇 < 0 concluímos que 𝐶𝑃 > 𝐶𝑉 .
𝜕𝑆 𝜕(𝑆, 𝑉 )
𝐶𝑉 = 𝑇 ( ) = 𝑇 .
Partindo de 𝐶𝑉 = (𝜕𝑈 )
𝜕𝑇 𝑉
pretendemos chegar a 𝜕𝑇 𝑉 𝜕(𝑇 , 𝑉 )
𝜕𝑆 Usando
𝐶𝑉 = 𝑇 (𝜕𝑇 )𝑉 . Se compararmos as duas expressões reparamos que a
energia interna se “transforma” na entropia! Um ansatz plausível é 𝜕(𝑢, 𝑣)
começar a demonstração com a primeira lei da Termodinâmica na 𝜕(𝑢, 𝑣) 𝜕(𝑢, 𝑣) 𝜕(𝑡, 𝑠) 𝜕(𝑡, 𝑠)
= =
formulação da entropia e a partir daí raciocinar construtivamente: 𝜕(𝑥, 𝑦) 𝜕(𝑡, 𝑠) 𝜕(𝑥, 𝑦) 𝜕(𝑥, 𝑦)
𝜕(𝑡, 𝑠)
𝑑𝑈 = 𝑇𝑑𝑆 − 𝑃𝑑𝑉 .
e fazendo 𝑢 = 𝑆, 𝑣 = 𝑦 = 𝑉 , 𝑥 = 𝑡 = 𝑇 , 𝑦 = 𝑉 𝑒 𝑠 = 𝑃 podemos
Dividindo a equação anterior por 𝑑𝑇 ficamos com reescrever 𝐶𝑉 como
𝑑𝑈 𝑑𝑆 𝑑𝑉 𝜕(𝑆, 𝑉 )
=𝑇 −𝑃 . 𝜕(𝑇 , 𝑃 )
𝑑𝑇 𝑑𝑇 𝑑𝑇 𝐶𝑉 = 𝑇 .
𝜕(𝑇 , 𝑉 )
Se tomarmos V como constante então 𝑑𝑉 = 0, pelo que 𝜕(𝑇 , 𝑃 )
𝜕𝑈 𝜕𝑆 Note-se que o numerador desta fração se pode calcular com o Teorema
( ) =𝑇( ) . de Laplace:
𝜕𝑇 𝑉 𝜕𝑇 𝑉
Mas
𝜕𝑈 𝜕𝑆 𝜕𝑆
( ) = 𝐶𝑉 , ( ) ( )
𝜕𝑇 𝑉 𝜕(𝑆, 𝑉 ) 𝜕𝑇 𝑃 𝜕𝑃 𝑇 𝜕𝑆 𝜕𝑉 𝜕𝑆 𝜕𝑉
= =( ) ( ) −( ) ( ) .
logo 𝜕(𝑇 , 𝑃 ) 𝜕𝑉 𝜕𝑉 𝜕𝑇 𝑃 𝜕𝑃 𝑇 𝜕𝑃 𝑇 𝜕𝑇 𝑃
( ) ( )
𝜕𝑆 | 𝜕𝑇 𝑃 𝜕𝑃 𝑇 |
𝐶𝑉 = 𝑇 ( ) . □
𝜕𝑇 𝑉
Da mesma forma se conclui que o denominador é (𝜕𝑉
𝜕𝑃 )𝑇 . Substituindo
Procedendo de forma análoga podemos chegar à fórmula de 𝐶𝑃 ! e fazendo uma ou outra manipulação algébrica tem-se
Sabemos que o entalpia é (𝜕𝑆 ) (𝜕𝑉 ) − ( 𝜕𝑆 ) (𝜕𝑉 )
𝜕𝑇 𝑃 𝜕𝑃 𝑇 𝜕𝑃 𝑇 𝜕𝑇 𝑃
𝐶𝑉 = 𝑇
𝐻 = 𝑈 + 𝑃𝑑𝑉 , 𝜕𝑉
( )
𝜕𝑃 𝑇
𝜕𝑆
( ) ( ) 𝜕𝑉 ( 𝜕𝑆 ) (𝜕𝑉 )
pelo que o seu diferencial será 𝜕𝑇 𝑃 𝜕𝑃 𝑇 𝜕𝑃 𝑇 𝜕𝑇 𝑃
=𝑇 −𝑇
(𝜕𝑉 ) (𝜕𝑉 )
𝑑𝐻 = 𝑑𝑈 + 𝑃𝑑𝑉 + 𝑉𝑑𝑝. 𝜕𝑃 𝑇 𝜕𝑃 𝑇
( 𝜕𝑆 ) (𝜕𝑉 )
𝜕𝑆 𝜕𝑃 𝑇 𝜕𝑇 𝑃
Como =𝑇 ( ) −𝑇 .
𝜕𝑇 𝑉 (𝜕𝑉 )
𝜕𝑃 𝑇
𝑑𝑈 = 𝑇𝑑𝑆 − 𝑃𝑑𝑉 ,
Ora, ora…
então 𝜕𝑆
𝑇 (𝜕𝑇 𝜕𝑆
)𝑉 é igual a 𝐶𝑃 e (𝜕𝑃 )𝑇 está presente numa das relações de
Maxwell:
𝑑𝐻 = 𝑇𝑑𝑆 + 𝑉𝑑𝑝.
𝜕𝑆 𝜕𝑉
Dividindo por 𝑑𝑇 obtemos ( ) = −( ) .
𝜕𝑃 𝑇 𝜕𝑇 𝑃
𝑑𝐻 𝑑𝑆 𝑑𝑃 Assim,
=𝑇 +𝑉 (𝜕𝑉 ) (𝜕𝑉 )
𝑑𝑇 𝑑𝑇 𝑑𝑇 𝜕𝑇 𝑃 𝜕𝑇 𝑃
𝐶𝑉 = 𝐶𝑃 + 𝑇 .
e se tomarmos P como constante tem-se 𝑑𝑃 = 0, ou seja, (𝜕𝑉 )
𝜕𝑃 𝑇
Ou ainda,
𝜕𝐻 𝜕𝑆 2
( ) =𝑇( ) .
𝜕𝑇 𝑃 𝜕𝑇 𝑃 (𝜕𝑉 )
𝜕𝑇 𝑃
𝐶𝑃 − 𝐶𝑉 = −𝑇 . □
(𝜕𝑉 )
Mas 𝜕𝑃 𝑇
𝜕𝐻
( ) = 𝐶𝑃 , Uma vez que (∂𝑉 / ∂𝑃 )𝑇 < 0, (∂𝑉 / ∂𝑇 )2𝑃 > 0 (por estar ao quadrado)
𝜕𝑇 𝑃
de onde se conclui que e −𝑇 < 0 (𝑇 > 0𝐾) então
𝜕𝑆
𝐶𝑃 = 𝑇 ( ) . □ 𝐶𝑃 − 𝐶 𝑉 > 0
𝜕𝑇 𝑃
(𝜕𝑉 2
𝜕𝑇 )𝑃
Ou, equivalentemente,
Para demonstrarmos que 𝐶𝑃 − 𝐶𝑉 = −𝑇 vamos partir de
(𝜕𝑉
𝜕𝑃 )𝑇 𝐶𝑃 > 𝐶𝑉 . □
Você também pode gostar
- Função exponencial (Parte 1Documento4 páginasFunção exponencial (Parte 1Claudio JuniorAinda não há avaliações
- Lista 7 - Regra Da Cadeia e Derivação ImplícitaDocumento4 páginasLista 7 - Regra Da Cadeia e Derivação ImplícitaLuisa Oliveira SantosAinda não há avaliações
- Aula 25 Cb0535 Webconferência 25.05.2022Documento8 páginasAula 25 Cb0535 Webconferência 25.05.2022Lucas CarvalhoAinda não há avaliações
- Investimento líquido empresa cosméticosDocumento3 páginasInvestimento líquido empresa cosméticosCarlos André JesusAinda não há avaliações
- Avaliao 2-Controle Analogico-Ralia Atista de OliveiraDocumento10 páginasAvaliao 2-Controle Analogico-Ralia Atista de OliveiraTHAYSA DANIELLY SOARES DA MOTAAinda não há avaliações
- Trabalho 2Documento3 páginasTrabalho 2todososnomesexperimentadosAinda não há avaliações
- Teorema das Funções Implícitas e Aplicações em MacroeconomiaDocumento8 páginasTeorema das Funções Implícitas e Aplicações em MacroeconomiaEmanuel McbrainAinda não há avaliações
- Eletrodinâmica Clássica – 1a ListaDocumento9 páginasEletrodinâmica Clássica – 1a ListaNicolas PessoaAinda não há avaliações
- Lista 2 (Gabarito)Documento5 páginasLista 2 (Gabarito)oDeinoAinda não há avaliações
- Resolução EDOs 1a ListaDocumento7 páginasResolução EDOs 1a ListaLuan OliveiraAinda não há avaliações
- APOSTILA - Eletro - MAG2 - Impedncia - e - Velocidades - Na - PropagaoDocumento13 páginasAPOSTILA - Eletro - MAG2 - Impedncia - e - Velocidades - Na - PropagaoAllan PivaAinda não há avaliações
- Análise de normas em M(3×3Documento5 páginasAnálise de normas em M(3×3Nathalie Freitas BicaAinda não há avaliações
- A+B valores triângulo círculos polinômioDocumento4 páginasA+B valores triângulo círculos polinômioLuiz Antonio Ponce AlonsoAinda não há avaliações
- Dedução Transferência de Calor e Resistência Térmica para Cilindro e EsferaDocumento2 páginasDedução Transferência de Calor e Resistência Térmica para Cilindro e EsferaVicenteFerrazAinda não há avaliações
- Reflexão em RetaDocumento4 páginasReflexão em RetaBarbaraAinda não há avaliações
- Solucionário Física III ondas e vibraçõesDocumento16 páginasSolucionário Física III ondas e vibraçõesRafael BarnozaAinda não há avaliações
- Funções trigonométricas e identidadesDocumento3 páginasFunções trigonométricas e identidadesJúlia VasconcelosAinda não há avaliações
- Coletânea Arconcher - Problema 01 (13-07-2023)Documento1 páginaColetânea Arconcher - Problema 01 (13-07-2023)Luiz Antonio Ponce AlonsoAinda não há avaliações
- Método Dos Elementos de ContornoDocumento11 páginasMétodo Dos Elementos de ContornoEstefânia CanzianAinda não há avaliações
- Lista de Exercícios de Matemática IDocumento49 páginasLista de Exercícios de Matemática IMagnus KellyAinda não há avaliações
- FICHA N 4 EQUACOES E INEQUACOES LOGARITMO (1)_231124_063808Documento7 páginasFICHA N 4 EQUACOES E INEQUACOES LOGARITMO (1)_231124_063808amarelinhocityAinda não há avaliações
- Análise de normas em espaços vetoriais de matrizesDocumento8 páginasAnálise de normas em espaços vetoriais de matrizesNathalie Freitas BicaAinda não há avaliações
- Guia 3 Parte 1 .De Estudo de Analise Numerica (26.04.2020) - 1Documento16 páginasGuia 3 Parte 1 .De Estudo de Analise Numerica (26.04.2020) - 1Jorge Pedro mateusAinda não há avaliações
- Lista de Exercícios TermodinâmicaDocumento2 páginasLista de Exercícios TermodinâmicaLeonardoAinda não há avaliações
- Ap1 2022-1Documento6 páginasAp1 2022-1Victor PereiraAinda não há avaliações
- APOSTILA - Eletro - MAG2 - Vetor - de - Poynting - e - PolarizaoDocumento9 páginasAPOSTILA - Eletro - MAG2 - Vetor - de - Poynting - e - PolarizaoAllan PivaAinda não há avaliações
- Exercícios de Revisão de (Alguns) Tópicos - Somativa 1 - RESPOSTASDocumento7 páginasExercícios de Revisão de (Alguns) Tópicos - Somativa 1 - RESPOSTASoliveira.guilherme0308Ainda não há avaliações
- Fundamentos da Mecânica ComputacionalDocumento3 páginasFundamentos da Mecânica ComputacionalMarcelo Gimenez MagalhãesAinda não há avaliações
- Relações entre propriedades termodinâmicasDocumento2 páginasRelações entre propriedades termodinâmicasAgda BorgesAinda não há avaliações
- Rodrigo Pena Teobaldo - 09 17 2023Documento5 páginasRodrigo Pena Teobaldo - 09 17 2023Rodrigo PenaAinda não há avaliações
- 09 Aula Potencial Elétrico 111Documento7 páginas09 Aula Potencial Elétrico 111Matheus ViniciusAinda não há avaliações
- 1 - Limite (Tudo)Documento80 páginas1 - Limite (Tudo)Philipp HassAinda não há avaliações
- Coletânea Chico Nery - Problema 26 (23-07-2023)Documento1 páginaColetânea Chico Nery - Problema 26 (23-07-2023)Luiz Antonio Ponce AlonsoAinda não há avaliações
- Tensão de Saída para o Circuito RLDocumento5 páginasTensão de Saída para o Circuito RLpedro juniorAinda não há avaliações
- Derivadas de ordens superiores em funções físicasDocumento11 páginasDerivadas de ordens superiores em funções físicasMateus Junior BaciqueteAinda não há avaliações
- Problemas de cálculo de áreas en coordenadas cartesianas y polaresDocumento3 páginasProblemas de cálculo de áreas en coordenadas cartesianas y polaresMaycol Gutierrez MontesinosAinda não há avaliações
- Cálculo II Integrais DuplasDocumento51 páginasCálculo II Integrais DuplasJamilsonMedeirosAinda não há avaliações
- (84927-69608) Prova 1 EaD Circuitos CA 2021 ADocumento4 páginas(84927-69608) Prova 1 EaD Circuitos CA 2021 ARodrigo EduardoAinda não há avaliações
- Subespaços vectoriaisDocumento8 páginasSubespaços vectoriaisAndrah SemedoAinda não há avaliações
- Aula - 02 - Eq - Schrodingers - 3DDocumento12 páginasAula - 02 - Eq - Schrodingers - 3DBiliane CostaAinda não há avaliações
- Notas de Aula - EDO - Semana 4Documento6 páginasNotas de Aula - EDO - Semana 4saymon breneAinda não há avaliações
- Transformada de Laplace de derivadaDocumento2 páginasTransformada de Laplace de derivadaLuma W. OliveiraAinda não há avaliações
- Lista de Exercícios 5Documento12 páginasLista de Exercícios 5Dannan cenouritahAinda não há avaliações
- Processo cíclico de um gás idealDocumento4 páginasProcesso cíclico de um gás idealLucasAinda não há avaliações
- Uz Mat 2 Exercicios Resolvidos e Ficha - 2021Documento6 páginasUz Mat 2 Exercicios Resolvidos e Ficha - 2021Clautino de Jesus ArmandoAinda não há avaliações
- HAGY RAILENNO - CONTROLE E AUTOMAÇÃODocumento3 páginasHAGY RAILENNO - CONTROLE E AUTOMAÇÃOHagy RailennoAinda não há avaliações
- Fasciculo de Física Da 12 ClasseDocumento44 páginasFasciculo de Física Da 12 ClasseMazutoAinda não há avaliações
- Distância entre ponto e planoDocumento12 páginasDistância entre ponto e planoHoracio JuniorAinda não há avaliações
- Ap1 2023-1Documento5 páginasAp1 2023-1Victor PereiraAinda não há avaliações
- Lista de Exercícios 4Documento5 páginasLista de Exercícios 4Dannan cenouritahAinda não há avaliações
- Tarefa3_BrunaMarcoJoao_CorrigidaDocumento5 páginasTarefa3_BrunaMarcoJoao_Corrigidajoaovictorhrn04Ainda não há avaliações
- ÁLGEBRA I - Espaços Vetoriais e Transformações LinearesDocumento19 páginasÁLGEBRA I - Espaços Vetoriais e Transformações LinearesÍtalo NatanAinda não há avaliações
- Função quadrática: conceitos e exemplosDocumento4 páginasFunção quadrática: conceitos e exemplosClaudio JuniorAinda não há avaliações
- Nota de Aula 07Documento4 páginasNota de Aula 07vendas1Ainda não há avaliações
- Derivadas - ParteDocumento13 páginasDerivadas - ParteAlejandro GomesAinda não há avaliações
- Derivação Implícita - Material de apoioDocumento2 páginasDerivação Implícita - Material de apoioRaphael Santos de AraújoAinda não há avaliações
- O Ensino Da Matemática Na Educação Básica Através Do Software GeogebraNo EverandO Ensino Da Matemática Na Educação Básica Através Do Software GeogebraAinda não há avaliações
- Caracterização de Compósitos Obtidos A Partir de Polímero Biodegradável e Casca de Arroz Utilizando Duas Técnicas de ProcessamentoDocumento16 páginasCaracterização de Compósitos Obtidos A Partir de Polímero Biodegradável e Casca de Arroz Utilizando Duas Técnicas de ProcessamentoLuan GabrielAinda não há avaliações
- Respostas de FisicaDocumento23 páginasRespostas de FisicaCarlos JuniorAinda não há avaliações
- Cálculo estrutural de laje, viga e pilar de concreto armadoDocumento41 páginasCálculo estrutural de laje, viga e pilar de concreto armadoAna Carolina ZanonAinda não há avaliações
- Dimensionamento de condutores por 5 métodosDocumento13 páginasDimensionamento de condutores por 5 métodosPatrick MalgarizeAinda não há avaliações
- Relatório espectroscopia gases rede difraçãoDocumento3 páginasRelatório espectroscopia gases rede difraçãoEder IvanAinda não há avaliações
- Interações Intermoleculares - ResumoDocumento3 páginasInterações Intermoleculares - ResumoLuana ReichertAinda não há avaliações
- WindshearDocumento24 páginasWindshearEduardo AlmeidaAinda não há avaliações
- Comercial Gama Lopes - Inspeção NR-13 - Compressor Parafuso Atlas Copco - 001 - 2023-2Documento11 páginasComercial Gama Lopes - Inspeção NR-13 - Compressor Parafuso Atlas Copco - 001 - 2023-2Genival SilvaAinda não há avaliações
- Ação do Vento em EstruturasDocumento41 páginasAção do Vento em EstruturasIgor OliveiraAinda não há avaliações
- Livros de resistência dos materiaisDocumento4 páginasLivros de resistência dos materiaisClaudioLimaMatos100% (1)
- Variabilidade térmica em Praia de MoledoDocumento2 páginasVariabilidade térmica em Praia de MoledoMariana JorgeAinda não há avaliações
- Operações FarmacêuticasDocumento34 páginasOperações FarmacêuticasRegina MarquesAinda não há avaliações
- Elementos química cristalinaDocumento15 páginasElementos química cristalinaDercioAinda não há avaliações
- OP3 - Unidade 1 - Parte 3Documento87 páginasOP3 - Unidade 1 - Parte 3Daniela I.Ainda não há avaliações
- Apostila EstatorDocumento9 páginasApostila EstatorviniciusAinda não há avaliações
- 5 Max Plus Dados Tecnicos Instalacao PDFDocumento5 páginas5 Max Plus Dados Tecnicos Instalacao PDFWagnerPocelliAinda não há avaliações
- Equipartição de EnergiaDocumento21 páginasEquipartição de EnergiaEdneide RamalhoAinda não há avaliações
- Propriedades de fluidosDocumento18 páginasPropriedades de fluidosLarcio LangaAinda não há avaliações
- Medição de vazão e instrumentosDocumento4 páginasMedição de vazão e instrumentosleandro3113Ainda não há avaliações
- Teoria Das Estruturas - Exercicios AulasDocumento22 páginasTeoria Das Estruturas - Exercicios AulasAline Marques de Araújo Aline100% (1)
- Propagação do calor e ondas: coletores solares e resfriamento por ventilaçãoDocumento9 páginasPropagação do calor e ondas: coletores solares e resfriamento por ventilaçãoCarlos Ramon Andrade de OliveiraAinda não há avaliações
- Códigos de Defeitos OBDIIDocumento47 páginasCódigos de Defeitos OBDIIFabio Barbosa100% (1)
- Tarefa 2Documento7 páginasTarefa 2valdeluziojuniorAinda não há avaliações
- Prova de Mecânica VibratóriaDocumento2 páginasProva de Mecânica VibratóriaRaphael Lira100% (1)
- Ligações Químicas: Iônicas, Covalentes e MetálicasDocumento27 páginasLigações Químicas: Iônicas, Covalentes e MetálicasYasmim RossafaAinda não há avaliações
- Aula Operações Unitárias III 14-04 - Destilação BateladaDocumento23 páginasAula Operações Unitárias III 14-04 - Destilação Bateladabininha89Ainda não há avaliações
- Relatório Técnico - 05 - PH e IndicadoresDocumento9 páginasRelatório Técnico - 05 - PH e IndicadoresbbonnieAinda não há avaliações
- 2 EspectrosDocumento22 páginas2 EspectrosLurdes LamasAinda não há avaliações
- 2aval Geo6ano IIcicloDocumento4 páginas2aval Geo6ano IIcicloNamaraAinda não há avaliações
- Projeto de muro de arrimo emDocumento7 páginasProjeto de muro de arrimo emjosezaidenAinda não há avaliações