Escolar Documentos
Profissional Documentos
Cultura Documentos
Aiqo 07
Enviado por
TheCleristDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Aiqo 07
Enviado por
TheCleristDireitos autorais:
Formatos disponíveis
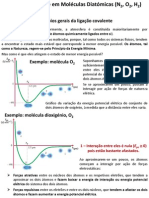
Em Química, radicais ou radicais livres representam átomos ou moléculas que contém um
número impar ou desemparelhado de elétrons na sua última camada eletrônica e, esse não
emparelhamento, deixam as moléculas muito instáveis e têm alto poder reativo. Quando
estas moléculas são liberadas pelo metabolismo do corpo por exemplo, com elétrons
instáveis e em consequência mais reativos, o que pode acarretar doenças degenerativas
ocasionando morte ou envelhecimento celular.
A presença de um elétron não emparelhado produz certas propriedades comuns que são
observadas pela maioria dos radicais. Muitos radicais são instáveis e altamente reativos.
Eles podem doar um elétron ou aceitar um elétron de outras moléculas, portanto,
comportando-se como oxidantes ou redutores.
Desta forma podemos definir um radical livre com senso um fragmento de uma molecula
carregando um ou mais elétrons desemparelhados e portanto, altamente reativo. Ocorrendo
durante a quebra das ligações químicas que podem acontecer seja de forma homolítica ou
heterolítica. Na quebra heterolítica há a formação de cargas opostas nos átomos que se
separaram uma vez que um deles fica com o par de elétrons e o outro perde (cátions e
ânions).
Na quebra homolítica não há formação de cargas, uma vez que cada átomo fica com um
elétron da ligação rompida. Esse átomo neutro com um elétron desemparelhado é
conhecido como radical livre (figura 3).
Figura 3: Formação de radicais pela quebra homolítica
Para este tipo de clivagem homolítica para gerar radicais livres, utilizamos dois métodos
menos drásticos:
→Utilização de calor a temperaturas não tão intensas (sendo assim necessário um composto que tenha
uma ligação intrinsecamente fraca). Os peróxidos são uma fonte comum de intermediários radicais
utilizando calor. Comumente são usados os iniciadores como peróxido de benzoílo, t-butil-
peroxibenzoato, peróxido de di-t-butil e hidroperóxido de t-butilo. A reação geralmente ocorre a uma
temperatura relativamente baixa (80-100 °C), a ligação oxigênio-oxigênio nos peróxidos é fraca (~30
kcal/mol) e a energia de ativação para a formação de radicais são baixos.
Figura 4: Formação de radicais por uma cisão homolítica pela da temperatura
→ Utilização de luz pode levar a fragmentação de um composto, se o comprimento de onda da luz
corresponder a uma energia maior do que a da ligação a ser clivada, e para levar a mesma ao estado de
excitação eletrônica. Para este tipo de formação de radicais utilizamos como exemplo os radicais
alcoxi de nitrito de alquilo ou hipocloritos.
Figura 5: Formação de radicais por uma cisão homolítica pela luz
No entanto podemos ter gerações de dirradicais. Este grupo pode ser definido como
espécies moleculares que têm dois elétrons desemparelhados, em que podem ser
identificados (mesma multiplicidade (estado singlete) ou diferentes multiplicidades (estado
tripleto)), pelo menos, dois estados eletrônicos diferentes.
São conhecidos pelas suas reatividades mais altas e tempos de vida mais curtos. Na
definição de dirradicais mais genérica as moléculas têm uma ligação a menos do que o
número permitido pelas regras padrão da teoria de ligação de valência. Os elétrons podem
emparelhar-se com spin oposto em um orbital molecular deixando o outro vazio.
A partir dessas características podemos ter a formação de dirradicais, mas que rapidamente
reagem para formar outro tipo de composto. Para este tipo de formação deve-se ter uma
dupla ligação (ligação π) que possa ser quebrada facilmente e levada para o estado
excitado da molécula.
Figura 6: Formação de dirradicais
A cicloaromatização de certos compostos orgânicos altamente insaturados pode formar
dirradicais. No entanto esta reação é altamente específica e instável como a ciclização de
Bergman para o eneodiino:
Figura 7: ciclização do Eneodiino
Você também pode gostar
- Resumo Do Capítulo 10Documento5 páginasResumo Do Capítulo 10Comuna KahloAinda não há avaliações
- Química 1A: Aula 3 - Ligações QuímicasDocumento26 páginasQuímica 1A: Aula 3 - Ligações QuímicasLavinia FagundesAinda não há avaliações
- Sem Título 1.odtDocumento5 páginasSem Título 1.odtfabiana barrosAinda não há avaliações
- Aula 4 - Ligacao QuimicaDocumento14 páginasAula 4 - Ligacao QuimicaCleitizzy Relaxado Buanamade BuanamadeAinda não há avaliações
- Ligações Químicas GrafiteDocumento15 páginasLigações Químicas GrafiteRodolfo FariasAinda não há avaliações
- Capítulo III Ligações QuímicasDocumento70 páginasCapítulo III Ligações QuímicasPedro SilvaAinda não há avaliações
- Reações RadicalaresDocumento4 páginasReações RadicalaresRafael Hélder MartinhoAinda não há avaliações
- Apostila Ligações Ionicas e CovalentesDocumento3 páginasApostila Ligações Ionicas e Covalentesjufontana7Ainda não há avaliações
- Apostila de Ligações QuímicasDocumento15 páginasApostila de Ligações QuímicasÍngrede Ferreira0% (1)
- Apostila 7 - Substâncias MolecularesDocumento24 páginasApostila 7 - Substâncias MolecularesNycollas SilvaAinda não há avaliações
- Ligaçoes QuimicasDocumento26 páginasLigaçoes QuimicasCAROLINE NEVES COSTAAinda não há avaliações
- Resumo para Prova de Ciências 9anoDocumento2 páginasResumo para Prova de Ciências 9anoxxgalaxy14xxAinda não há avaliações
- Capitulo Vi Ligaçoes QuimicasDocumento57 páginasCapitulo Vi Ligaçoes QuimicasBranca LopesAinda não há avaliações
- Elo BasDocumento54 páginasElo BasMiro MotaAinda não há avaliações
- Eletroquimica Relatorio 2Documento9 páginasEletroquimica Relatorio 2CMEI MDMCAinda não há avaliações
- Ligações 1Documento19 páginasLigações 1Wältër PömpïlïöAinda não há avaliações
- Trabalho Condutores Semicondutores Isolantes SupercondutoresDocumento8 páginasTrabalho Condutores Semicondutores Isolantes SupercondutoresSandro ValladoAinda não há avaliações
- Resumo - QuímicaDocumento7 páginasResumo - QuímicaLETICIA CAUANE SANTOS VITALAinda não há avaliações
- Ligações Químicas CovalentesDocumento6 páginasLigações Químicas CovalentesCarlos FerreiraAinda não há avaliações
- Os Elementos e Suas PropriedadesDocumento86 páginasOs Elementos e Suas Propriedadesluiz13eduardoAinda não há avaliações
- Relatório 7 Fisq 2 Exp. PilhasDocumento7 páginasRelatório 7 Fisq 2 Exp. PilhasThais KovacAinda não há avaliações
- Trabalho de Química PDFDocumento18 páginasTrabalho de Química PDFLetício FranciscoAinda não há avaliações
- Parte - III - Reações Orgânicas PDFDocumento84 páginasParte - III - Reações Orgânicas PDFArnaldo Carlos MorelliAinda não há avaliações
- 06 - Liga Es Qu Micas e Resson NciaDocumento30 páginas06 - Liga Es Qu Micas e Resson NciaRaiplayG10 []Ainda não há avaliações
- Química 2 SérieDocumento4 páginasQuímica 2 SérieJosileide De Castro SantanaAinda não há avaliações
- Trabalho de QuímicaDocumento10 páginasTrabalho de QuímicaPaulo António JúniorAinda não há avaliações
- Propriedades Fisico Quimicas Acidez Basicidade Compostos Orgânicos 2018Documento90 páginasPropriedades Fisico Quimicas Acidez Basicidade Compostos Orgânicos 2018RomeuComastriAbdalaAinda não há avaliações
- Escola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaDocumento92 páginasEscola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaMerlohnAinda não há avaliações
- Ligações QuímicasDocumento4 páginasLigações QuímicasWellington PimentelAinda não há avaliações
- Bioquimica VegetalDocumento57 páginasBioquimica VegetalSusana SantosAinda não há avaliações
- ATIVIDADeDocumento4 páginasATIVIDADePablo ViniciusAinda não há avaliações
- Moléculas Na Troposfera IDocumento14 páginasMoléculas Na Troposfera IpccsimoesAinda não há avaliações
- Apostila 7 - Subst Ncias MolecularesDocumento24 páginasApostila 7 - Subst Ncias MolecularesPaulo SérgioAinda não há avaliações
- Plano de Aula Ligações QuimicasDocumento10 páginasPlano de Aula Ligações QuimicasHelena Brites RodriguesAinda não há avaliações
- Aula 6 - QuímicaDocumento30 páginasAula 6 - QuímicaBeatriz MenezesAinda não há avaliações
- Ligações Químicas - Prof. Sérgio MatosDocumento5 páginasLigações Químicas - Prof. Sérgio MatosÉrica RamosAinda não há avaliações
- Estudo Da MateriaDocumento9 páginasEstudo Da MateriaMarcos ErikeAinda não há avaliações
- 1 QuimicaDocumento16 páginas1 QuimicaDj Junior DsAinda não há avaliações
- Aula6 Estadosolido1Documento31 páginasAula6 Estadosolido1Jack JokerAinda não há avaliações
- Fotossíntese Das PlantasDocumento67 páginasFotossíntese Das PlantasLeonardo Fernando100% (1)
- Des e Aplicações Dos Metais e LigasDocumento42 páginasDes e Aplicações Dos Metais e Ligassocramsilva100% (10)
- Ligacoes Quimicas para EJADocumento11 páginasLigacoes Quimicas para EJAAlda ErnestinaAinda não há avaliações
- Pilha CarvãoDocumento4 páginasPilha CarvãoLara MachadoAinda não há avaliações
- FlourimetriaDocumento13 páginasFlourimetriaNeto LourencoAinda não há avaliações
- Tipos de Ligações Químicas 2Documento12 páginasTipos de Ligações Químicas 2Maria TrindadeAinda não há avaliações
- Propriedades e Estruturas Dos Compostos QuímicosDocumento11 páginasPropriedades e Estruturas Dos Compostos QuímicosJonesM CraftAinda não há avaliações
- Forças IntermolecularesDocumento59 páginasForças IntermolecularesSaverio Silva100% (1)
- Termoquímica LeituraDocumento43 páginasTermoquímica Leituravikttordbas14Ainda não há avaliações
- Organica SalvaçaoDocumento5 páginasOrganica SalvaçaoEllen CarvalhoAinda não há avaliações
- Biologia Molecular Da CélulaDocumento4 páginasBiologia Molecular Da CélulajoaoAinda não há avaliações
- Ligacoes QuimicasDocumento7 páginasLigacoes QuimicasLúbio LuisAinda não há avaliações
- Trabalho - Ligações QuímicasDocumento25 páginasTrabalho - Ligações QuímicascarolineaugustaAinda não há avaliações
- MoleculeDocumento11 páginasMoleculePrincepe NamorAinda não há avaliações
- The Effect of Magnetic Field On The Activity of Superoxide Dismutase PT-BRDocumento6 páginasThe Effect of Magnetic Field On The Activity of Superoxide Dismutase PT-BRdfninformaticaaulasAinda não há avaliações
- EletronicaDocumento73 páginasEletronicaIvan Dimitry ZyrianoffAinda não há avaliações
- Aula 01 - Introdução A Ciencia Dos MateriaisDocumento18 páginasAula 01 - Introdução A Ciencia Dos MateriaisMichele SilvaAinda não há avaliações
- Membrana Plasmática - Interações QuímicasDocumento8 páginasMembrana Plasmática - Interações QuímicasMaria Karoline Vasconcellos De AzevedoAinda não há avaliações
- Estudos Dipolos e Quadrupolos ElétricosDocumento13 páginasEstudos Dipolos e Quadrupolos ElétricosAlessandro Dos Santos RochaAinda não há avaliações
- Aiqo 10Documento4 páginasAiqo 10TheCleristAinda não há avaliações
- Aiqo 09Documento3 páginasAiqo 09TheCleristAinda não há avaliações
- Aiqo 08Documento2 páginasAiqo 08TheCleristAinda não há avaliações
- Aiqo 03Documento1 páginaAiqo 03TheCleristAinda não há avaliações
- Aiqo 04Documento1 páginaAiqo 04TheCleristAinda não há avaliações
- Atividade de Química Haletos AIQO-02Documento1 páginaAtividade de Química Haletos AIQO-02TheCleristAinda não há avaliações
- Aiqo 01Documento2 páginasAiqo 01TheCleristAinda não há avaliações
- Estudo Dirigido - Quimica GEral TampletesDocumento2 páginasEstudo Dirigido - Quimica GEral TampletesTheCleristAinda não há avaliações
- Estágio Curricular Obrigatório - Estágio IIIDocumento17 páginasEstágio Curricular Obrigatório - Estágio IIITheCleristAinda não há avaliações
- Estágio II - Relatório de GlicoseDocumento28 páginasEstágio II - Relatório de GlicoseTheCleristAinda não há avaliações
- 05 Livro Manejo Da Salinidade Parte5Documento106 páginas05 Livro Manejo Da Salinidade Parte5Roberto Vieira PordeusAinda não há avaliações
- Agentes AntiestáticosDocumento23 páginasAgentes AntiestáticosAndré Luís Aganeti0% (1)
- 19 Corrente Eletrica e Suas FontesDocumento8 páginas19 Corrente Eletrica e Suas FontesAmorindo SebastiãoAinda não há avaliações
- Tabela de Materiais (Durezas)Documento1 páginaTabela de Materiais (Durezas)Projetos Geiger100% (1)
- Tipos de Vapor e Suas AplicaçõesDocumento2 páginasTipos de Vapor e Suas Aplicaçõesvictorvalani100% (1)
- Efluentes Domésticos e IndustriaisDocumento18 páginasEfluentes Domésticos e IndustriaisClaudiana SilvaAinda não há avaliações
- Acetileno PDFDocumento9 páginasAcetileno PDFFerreira SouzaAinda não há avaliações
- BC8001 Design Manual Portugues PDFDocumento21 páginasBC8001 Design Manual Portugues PDFFabio Alves67% (3)
- Resumo Das Fórmulas de Rendimentos e Eficiência Utilizadas Na Indústria Açucareira Do BrasilDocumento16 páginasResumo Das Fórmulas de Rendimentos e Eficiência Utilizadas Na Indústria Açucareira Do BrasilFernanda Lima Silva100% (1)
- Aplicação Da Ressonância Magnética Nuclear 1H Na Identificação de Produtos NaturaisDocumento47 páginasAplicação Da Ressonância Magnética Nuclear 1H Na Identificação de Produtos NaturaisNelson Filho100% (1)
- Química V2 PDFDocumento326 páginasQuímica V2 PDFrodrigo100% (1)
- Aula 11 - Magnetismo e Materiais Magneticos 01Documento18 páginasAula 11 - Magnetismo e Materiais Magneticos 01rayanefreAinda não há avaliações
- Avaliações 1º, 3º, 4º e 5º AnosDocumento107 páginasAvaliações 1º, 3º, 4º e 5º Anosjaqueline AbreuAinda não há avaliações
- QuestionárioDocumento1 páginaQuestionárioangelocarlosAinda não há avaliações
- Catalogo Canal de Drenagens FuminasDocumento8 páginasCatalogo Canal de Drenagens FuminasKassioRodriguesAinda não há avaliações
- Gtec - Port Chave de TransferenciaDocumento6 páginasGtec - Port Chave de TransferenciaRenan CesarAinda não há avaliações
- Aula 3 CienciasDocumento4 páginasAula 3 CienciasValquiria PalhanoAinda não há avaliações
- Apostila Bota Nica Criptoga Mica Atual PDFDocumento63 páginasApostila Bota Nica Criptoga Mica Atual PDFMartival SantosAinda não há avaliações
- LubrificaçãoDocumento152 páginasLubrificaçãoJean Kelvin MenezesAinda não há avaliações
- Exercicios Modulo 24 Aula 1Documento3 páginasExercicios Modulo 24 Aula 1Thales MogariAinda não há avaliações
- Simbolos ISADocumento15 páginasSimbolos ISAanon-484829100% (5)
- BasesDocumento4 páginasBasesVanessa VieiraAinda não há avaliações
- Lista de Exercícios 1Documento2 páginasLista de Exercícios 1Olympio NetoAinda não há avaliações
- Apostila de Hidráulica PDFDocumento240 páginasApostila de Hidráulica PDFAntonio_S_LimaAinda não há avaliações
- Trocadores de Calor Nas Usinas de Açúcar, Etanol e Energia (Amostra)Documento22 páginasTrocadores de Calor Nas Usinas de Açúcar, Etanol e Energia (Amostra)Thiago LinsAinda não há avaliações
- Cap 1 - Nomenclatura ResumoDocumento42 páginasCap 1 - Nomenclatura Resumosofis2013Ainda não há avaliações
- Exper 7 DifusãoDocumento3 páginasExper 7 DifusãoMarina Vieira de OliveiraAinda não há avaliações
- Estrutura Interna Da GeosferaDocumento37 páginasEstrutura Interna Da GeosferaCarlos Eduardo Abreu AmorimAinda não há avaliações
- Exp. 4Documento6 páginasExp. 4Gus LAinda não há avaliações
- BiomateriaisDocumento22 páginasBiomateriaisRaquel Filgueira de Souza FerreiraAinda não há avaliações