Escolar Documentos
Profissional Documentos
Cultura Documentos
Teoria Molecular
Enviado por
psyjunior10 notas0% acharam este documento útil (0 voto)
6 visualizações2 páginasTítulo original
teoria molecular
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
6 visualizações2 páginasTeoria Molecular
Enviado por
psyjunior1Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 2
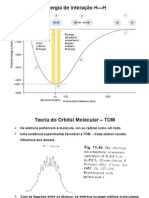
A teoria do orbital molecular surge para explicar dados
experimentais falhos na teoria de ligações de valência.
Para resolver uma molécula simples de H2+
hidrogênio consiste em achar uma função de onda
que minimize a energia total do sistema calculado
pela equação de Schrodinger.
A função de onda tem a mesma propriedade que os
orbitais atômicos. qualquer rotação desta função
também e uma solução da equação de Schrodinger.
Essa função contem toda a informação necessária
para se obter a propriedade observáveis da
molécula, como por exemplo momento de dipolo,
energia cinética potencial de ionização.
Ou seja a probabilidade de se encontrar o elétron e
invariante com relação a rotação da função de onda
no espaço. Em termos da física moderna, dissemos
que a função de onda tem de ser antissimétrica com
relação a troca das coordenadas de dois elétron.
No caso da moleca de hidrogênio, o principio da
antissimétrica e garantido se lembramos que cada
orbital molecular pode ser ocupado com no máximo
dois elétron com espins oposto. O método comum e a
combinação linear de orbitais atômicos, ou seja ,
para o exemplo da molécula de H2 onde o subscrito
A e B se referem ao dois átomos de hidrogênio, 1s e
o respectivo orbital e os coeficientes c1 e c2 dever
ser determinado de modos a minimiza a energia, ou
seja, permitir a melhor combinação entre os orbitais
atômicos.
O orbital 1s dos átomos hidrogênio A e B se
combinam para forma dois orbitais moleculares, um
mais estável, chamado antiligantes. Observa-se que
os orbitais moleculares de mais baixa energia são
ocupados primeiramente. Temos assim outra forma
de explicar a formação da ligação química. Cada
orbital atômico contribuiria com dois elétron
consequentemente com a formação da molécula ; os
orbitais moleculares ligante e antiligante estariam
ocupado, no caso do exemplo da molécula hipotética
He2+. A estabilização devido a formação do orbital
ligante seria completamente perdida com a
ocupação do orbital antiligante que desestabiliza o
sistema.
Dizemos que ouve a formação de uma ligação
química covalente, onde dois elétron são igualmente
compartilhado c1=c2.
A TOM e largamente usada qualitativamente para
racionalizar a reação química seja na química
orgânica, e na orgânica, bioquímica. Atualmente,
calculo preciso são possível de seres feito devido ao
grande desenvolvimento dos computadores e de
metodologia dos calculo teórico. A grande vantagem
da TOM e que nenhum conhecimento prévio da
molécula e necessário, apenas as quatros constante
básica da física, a saber: velocidade da luz,
constante de Planck, carga do elétron e o numero
atômico (Z) são necessária.
Você também pode gostar
- Trocador de CalorDocumento2 páginasTrocador de CalorandreAinda não há avaliações
- Tom CloaDocumento4 páginasTom CloaJosé BritesAinda não há avaliações
- Aula 5 - Ligações Químicas Parte IIDocumento60 páginasAula 5 - Ligações Químicas Parte IIGustavo Carvalho SilvaAinda não há avaliações
- TOM Aula Formulas Funcao OndaDocumento11 páginasTOM Aula Formulas Funcao OndaLUIZA NAZARETHAinda não há avaliações
- Compostos ComplexosDocumento9 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- ResumosDocumento43 páginasResumosGuilherme RodriguesAinda não há avaliações
- Exercicios 1Documento8 páginasExercicios 1giglepurpleAinda não há avaliações
- CAPITULO 1.qmcorDocumento78 páginasCAPITULO 1.qmcorAgustín SilesAinda não há avaliações
- Esperanca, Teoria AtomicaDocumento6 páginasEsperanca, Teoria AtomicateodosiochaveAinda não há avaliações
- Quimica Geral - ResumoDocumento5 páginasQuimica Geral - ResumoAndrew GamaAinda não há avaliações
- Teoria Do Orbital MolecularDocumento17 páginasTeoria Do Orbital MolecularAlexandre MedinaAinda não há avaliações
- Ligaçoes QuimicasDocumento26 páginasLigaçoes QuimicasCAROLINE NEVES COSTAAinda não há avaliações
- Quimica Dos Compostos Inorganicos I Aula 6Documento28 páginasQuimica Dos Compostos Inorganicos I Aula 6Caroline FerreiraAinda não há avaliações
- Equilíbrio Na EletroquímicaDocumento17 páginasEquilíbrio Na EletroquímicaHumbervania Reis GonçalvesAinda não há avaliações
- 11514801032012fundamentos de Fisico-Quimica Aula 13Documento17 páginas11514801032012fundamentos de Fisico-Quimica Aula 13Liciani Inae PuttiAinda não há avaliações
- Cap.9 McQuarrieDocumento55 páginasCap.9 McQuarriekarinaAinda não há avaliações
- Aplicação Da Teoria Do Orbital MolecularDocumento14 páginasAplicação Da Teoria Do Orbital MolecularTatianyAinda não há avaliações
- Tom 1Documento134 páginasTom 1Josiel HenryAinda não há avaliações
- Livro de EletroquimicaDocumento17 páginasLivro de EletroquimicaFernanda AlvesAinda não há avaliações
- Formacao H2 H2O e PAHsDocumento10 páginasFormacao H2 H2O e PAHsEquilibrium EduardoAinda não há avaliações
- Ligações Covalentes - TomDocumento64 páginasLigações Covalentes - TomMarcus Vinicius100% (1)
- Cloreto de HexamincobaltoIIIDocumento13 páginasCloreto de HexamincobaltoIIIYuri GomesAinda não há avaliações
- 18414816022012quimica Dos Compostos Inorganicos II Aula 7Documento19 páginas18414816022012quimica Dos Compostos Inorganicos II Aula 7Mi_MDAinda não há avaliações
- 09132604042014quimica Inorganica II Aula 7Documento19 páginas09132604042014quimica Inorganica II Aula 7NOOB FilosóficoAinda não há avaliações
- Unidade 4-2010Documento26 páginasUnidade 4-2010Mango lavoAinda não há avaliações
- Química QuânticaDocumento5 páginasQuímica QuânticaKennyaThayresLima100% (1)
- Física Quântica - 2021.3 - QS - Lista 3 - Tema: Espectros e Modelos Atômicos (De Dalton À Bohr) GabaritoDocumento7 páginasFísica Quântica - 2021.3 - QS - Lista 3 - Tema: Espectros e Modelos Atômicos (De Dalton À Bohr) GabaritoAndre Luiz CostaAinda não há avaliações
- Ligações Iônicas e MolecularesDocumento61 páginasLigações Iônicas e MolecularessiriuschavesAinda não há avaliações
- Universidade Estadual de Feira de SantanaDocumento11 páginasUniversidade Estadual de Feira de SantanaEdmondDantesAinda não há avaliações
- Survival Attempt FinalDocumento6 páginasSurvival Attempt Finalduarteriscado2Ainda não há avaliações
- Estrutura MolecularDocumento65 páginasEstrutura MolecularStefanie MarinhoAinda não há avaliações
- Edil Química Orgânica Unidade 1 - Teoria EstruturalDocumento132 páginasEdil Química Orgânica Unidade 1 - Teoria Estruturalleticia trindadeAinda não há avaliações
- 2021 SemifinalDocumento12 páginas2021 SemifinaliolaAinda não há avaliações
- The Drude ModelDocumento15 páginasThe Drude ModelGabriel Henrique BatistaAinda não há avaliações
- Ligação Covalente Parte I PDFDocumento92 páginasLigação Covalente Parte I PDFigor santosAinda não há avaliações
- Resumo de Química Geral IDocumento20 páginasResumo de Química Geral IAna Paula Do NascimentoAinda não há avaliações
- Tom 1 PDFDocumento42 páginasTom 1 PDFmanuellaamattos19Ainda não há avaliações
- Enlaces Químicos Da Matéria 171119Documento18 páginasEnlaces Químicos Da Matéria 171119marcoAinda não há avaliações
- Camada de DifusãoDocumento28 páginasCamada de DifusãoLeandro HerculanoAinda não há avaliações
- Ligações Químicas III 050614Documento64 páginasLigações Químicas III 050614wrafael1Ainda não há avaliações
- 1.estrutura e ReatividadeDocumento34 páginas1.estrutura e ReatividadeLucas Roniery100% (1)
- Compostos de Coordenação - Parte 5Documento22 páginasCompostos de Coordenação - Parte 5Bruno AlvesAinda não há avaliações
- Teoria Do Orbital Molecular: Orbitais Nas MoléculasDocumento32 páginasTeoria Do Orbital Molecular: Orbitais Nas MoléculasMahira AdnaAinda não há avaliações
- David Ball Cap8 SmallsizeDocumento36 páginasDavid Ball Cap8 SmallsizeJoy AndradeAinda não há avaliações
- Es CAP8 2020Documento22 páginasEs CAP8 2020annonAinda não há avaliações
- 1 Propriedades Dos AtomosDocumento4 páginas1 Propriedades Dos Atomosjanildes.ufrbAinda não há avaliações
- Teoria Da Ligação de Valência (RPECV)Documento16 páginasTeoria Da Ligação de Valência (RPECV)TatianyAinda não há avaliações
- Geometria Molecular ResumoDocumento10 páginasGeometria Molecular ResumoPedro Ricardo BessowAinda não há avaliações
- F2.7 Ficha7 QuímicaDocumento6 páginasF2.7 Ficha7 QuímicaÂngela Carneiro100% (1)
- Química GeralDocumento6 páginasQuímica GeralannaAinda não há avaliações
- Sandrogrecoorbitais e Ligaes Qumicas 1210810468120454 9Documento22 páginasSandrogrecoorbitais e Ligaes Qumicas 1210810468120454 9giselesilvestreAinda não há avaliações
- Ligacao CovalenteDocumento12 páginasLigacao CovalenterodrigomenegazgoularAinda não há avaliações
- Modelo de DrudeDocumento12 páginasModelo de DrudeRafael Triani100% (1)
- Relatório BetacarotenoDocumento13 páginasRelatório Betacarotenowalas joãoAinda não há avaliações
- 2a Lista de Exercicios Eletroquimica e Metálicas 2014Documento6 páginas2a Lista de Exercicios Eletroquimica e Metálicas 2014Jesus EmanuelAinda não há avaliações
- Aula 3 Teoria Dos Orbitais Moleculares TOMDocumento30 páginasAula 3 Teoria Dos Orbitais Moleculares TOManon_992304409100% (1)
- Aula 1 - Ligações Quimicas em QoDocumento42 páginasAula 1 - Ligações Quimicas em QoMarcioAinda não há avaliações
- Atividade Revisional Geometria Molecular e Polaridade Das Ligações.Documento5 páginasAtividade Revisional Geometria Molecular e Polaridade Das Ligações.Abraão MattosAinda não há avaliações
- Teoria de Bohr para o Átomo de HidrogênioDocumento11 páginasTeoria de Bohr para o Átomo de Hidrogêniomickey_ze100% (1)
- Compostos ComplexosDocumento14 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- Princípios Da IrradiaçãoDocumento3 páginasPrincípios Da IrradiaçãoDaniele LimaAinda não há avaliações
- Durabilidade Dos Concretos - Permeabilidade - Corrosão Eletrolítica - BasílioDocumento22 páginasDurabilidade Dos Concretos - Permeabilidade - Corrosão Eletrolítica - BasílioNeyAinda não há avaliações
- Dobra Espacial Ou Propulsão de AlcubierreDocumento3 páginasDobra Espacial Ou Propulsão de AlcubierreGabrielAinda não há avaliações
- Aef11 Prop Sol Fichas FormativasDocumento5 páginasAef11 Prop Sol Fichas FormativasadivinhoeuAinda não há avaliações
- Relatório Da Aula ExperimentalDocumento5 páginasRelatório Da Aula ExperimentalIsaura SilvaAinda não há avaliações
- Universo e Evolução Joao BerbelDocumento122 páginasUniverso e Evolução Joao BerbelAry MedeirosAinda não há avaliações
- Conf Termico COIMBRADocumento19 páginasConf Termico COIMBRAmrbuzanelloAinda não há avaliações
- Relatório de Química Orgânica IIIDocumento14 páginasRelatório de Química Orgânica IIICarolina Mariano100% (1)
- Ficha Rev 11Documento6 páginasFicha Rev 11sasfernandesAinda não há avaliações
- P1 - Ciências - 2° Trimestre - 9º AnoDocumento6 páginasP1 - Ciências - 2° Trimestre - 9º AnoEsther CanellaAinda não há avaliações
- Acionamentos Eletricos 1Documento6 páginasAcionamentos Eletricos 1Rogerio DiasAinda não há avaliações
- Materiais de Construção II - MetaisDocumento91 páginasMateriais de Construção II - MetaisSalomão Silva NetoAinda não há avaliações
- Alkabel 122Documento5 páginasAlkabel 122JoaoAinda não há avaliações
- Semana 2 Leonardo Gomes (Caio Rodrigues) (Guilherme Brigagão)Documento9 páginasSemana 2 Leonardo Gomes (Caio Rodrigues) (Guilherme Brigagão)Igor SantosAinda não há avaliações
- Atividade 2 - Relatório - Reflexão Total e Angulo Limite - Marcello Jhojenny Lopes Silva AlmeidaDocumento11 páginasAtividade 2 - Relatório - Reflexão Total e Angulo Limite - Marcello Jhojenny Lopes Silva AlmeidaMarcello JhOjEnNyAinda não há avaliações
- Lista 2Documento2 páginasLista 2Gustavo StinguelAinda não há avaliações
- E-Book Calha Parshall o Medidor Que Revolucionou A Medio de Vazo No Mundo 1Documento10 páginasE-Book Calha Parshall o Medidor Que Revolucionou A Medio de Vazo No Mundo 1Isabelly NalessoAinda não há avaliações
- 3 Missimulado - Termologia+ÓpticaDocumento11 páginas3 Missimulado - Termologia+ÓpticahuggosoutoAinda não há avaliações
- Reologia de Fluidos - ApostilaDocumento11 páginasReologia de Fluidos - ApostilaCleiser ThiagoAinda não há avaliações
- Ficha Sobre Sismicidade PDFDocumento4 páginasFicha Sobre Sismicidade PDFVânia Maria SantosAinda não há avaliações
- Fisicadamateria Fase3 Atv1Documento5 páginasFisicadamateria Fase3 Atv1Erialdo JerônimoAinda não há avaliações
- Aglomerantes 1Documento30 páginasAglomerantes 1Letícia FreitasAinda não há avaliações
- Termodinâmica - Aula 4 e 5 - Propriedades de SubstâniciasDocumento63 páginasTermodinâmica - Aula 4 e 5 - Propriedades de Substâniciassmarts777Ainda não há avaliações
- Unidade 01 - Ciência Dos Materiais - Aula 02 - 02.09.2021Documento85 páginasUnidade 01 - Ciência Dos Materiais - Aula 02 - 02.09.2021Theo MenezesAinda não há avaliações
- Adubação e Nutrição Da CebolaDocumento10 páginasAdubação e Nutrição Da CebolaFelipe SouzaAinda não há avaliações
- Oscilações Sistema Massa-MolaDocumento11 páginasOscilações Sistema Massa-MolaMariana ToledoAinda não há avaliações
- AstronomiaDocumento221 páginasAstronomiaJunior CarvalhoAinda não há avaliações
- Relatório de Fisíco-QuímicaDocumento10 páginasRelatório de Fisíco-QuímicaNoelia RochaAinda não há avaliações
- Materialdeapoioextensivo Biologia Exercicios FotossinteseDocumento3 páginasMaterialdeapoioextensivo Biologia Exercicios Fotossintesemister pigAinda não há avaliações