Escolar Documentos
Profissional Documentos
Cultura Documentos
Q1 2.3. Fatores Que Alteram o Equilíbrio Químico
Enviado por
diana0 notas0% acharam este documento útil (0 voto)
16 visualizações19 páginasTítulo original
Q1 2.3. Fatores que alteram o equilíbrio químico
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
16 visualizações19 páginasQ1 2.3. Fatores Que Alteram o Equilíbrio Químico
Enviado por
dianaDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 19
Equilíbrio químico e extensão das reações químicas
2.3. Fatores que alteram o equilíbrio químico
Na indústria química, torna-se muito relevante o estudo dos fatores
que podem aumentar a extensão da reação direta (ou inversa),
tornando o processo de síntese de uma determinada substância
economicamente mais rentável, por aumentar o rendimento da
reação.
Os fatores que podem alterar o estado de equilíbrio de um sistema
reacional são:
• a concentração de um reagente ou de um produto da reação;
• a temperatura do sistema;
• a pressão/volume, em sistemas gasosos.
O que acontece a um sistema em equilíbrio quando se altera um
dos fatores de que depende o equilíbrio?
Princípio de Le Châtelier
O Princípio de Le Châtelier permite prever a
evolução de um sistema inicialmente em
equilíbrio, quando ocorre variação de um
dos fatores que podem afetar o estado de
equilíbrio – concentração, pressão/volume
ou temperatura. Henri Louis Le Châtelier
(1850-1936)
Princípio de le Châtelier - Quando, a um sistema em equilíbrio, se
altera um dos fatores de que depende esse equilíbrio, o sistema
evolui no sentido de contrariar essa perturbação.
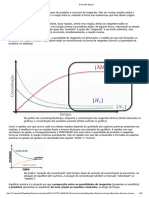
1) Influência da concentração
Aumento da concentração de reagente
Qc < K c
A adição de reagente faz evolui o sistema no sentido do consumo
de reagente adicionado e da formação de produto (NO2),
evoluindo, assim, o sistema no sentido direto.
2) Influência da pressão total sobre o sistema
O aumento da pressão (por diminuição de volume) desloca o
equilíbrio no sentido da menor quantidade química de substâncias
no estado gasoso.
Resumindo…
Quando se aumenta a pressão por diminuição do volume
(compressão) de um sistema em equilíbrio, a reação evolui no
sentido do menor número de moléculas no estado gasoso,
dado que contraria o efeito do aumento de pressão.
Quando se diminui a pressão por aumento do volume
(expansão) de um sistema em equilíbrio, a reação evolui no
sentido do maior número de moléculas no estado gasoso,
dado que contraria o efeito da diminuição de pressão.
3) Influência da temperatura
Incolor Vermelho-
-acastanhado
Quando se aquece a mistura em equilíbrio, a cor da mistura
reacional fica mais escura e quando se arrefece fica mais clara.
Influência de catalisadores
O uso de um catalisador influencia da mesma forma a velocidade das
reações direta e inversa, mas não afeta o valor da constante de
equilíbrio nem o rendimento obtido no processo.
Síntese de conteúdos
• Os fatores que podem alterar o estado de equilíbrio de uma
mistura reacional são: a pressão/volume, em sistemas gasosos, a
temperatura do sistema, a concentração de um reagente ou
produto da reação.
• Princípio de Le Châtelier – Quando, a um sistema em equilíbrio,
se altera um dos fatores de que depende esse equilíbrio, o
sistema evolui no sentido de contrariar essa perturbação.
• Quando se faz variar a concentração de um reagente ou produto
num sistema inicialmente em equilíbrio, o equilíbrio evolui no
sentido que permita que o valor de Qc volte a igualar o valor de Kc.
Isto é, em qualquer sistema em equilíbrio, a adição de um
reagente ou de um produto favorece a evolução da reação no
sentido em que consome parte da substância adicionada, até se
restabelecer um novo equilíbrio. A remoção de um reagente ou
produto provoca um efeito contrário.
Síntese de conteúdos
• Quando se aumenta a pressão por diminuição do volume
(compressão) de um sistema em equilíbrio, a reação evolui no
sentido do menor número de moléculas no estado gasoso, dado
que contraria o efeito do aumento de pressão; quando se diminui
a pressão por aumento do volume (expansão) de um sistema em
equilíbrio, a reação evolui no sentido do maior número de
moléculas no estado gasoso, dado que contraria o efeito da
diminuição de pressão.
• O aumento da temperatura de um sistema em equilíbrio faz
evoluir a reação no sentido da reação endotérmica até atingir um
novo estado de equilíbrio. A diminuição da temperatura de um
sistema em equilíbrio faz evoluir a reação no sentido da reação
exotérmica até atingir um novo estado de equilíbrio.
• O uso de um catalisador diminui o tempo necessário para o
sistema reacional atingir o equilíbrio químico, mas não altera o
valor de Kc nem o rendimento da reação.
Diagrama de conteúdos
Exercício resolvido
6. Um método de produção, em fase gasosa, de cianeto de
hidrogénio é baseado na reação entre o acetileno, C2H2, e o
nitrogénio, N2, de acordo com a equação química seguinte:
N2(g) + C2H2(g) ⇌ 2 HCN(g)
A figura ao lado indica os valores das
concentrações de N2, C2H2 e HCN no
equilíbrio, para várias temperaturas.
6.1 Determine a constante de
equilíbrio da reação de síntese de
HCN a temperatura de 300 °C.
6.2 Que condições favorecem a
síntese de cianeto de hidrogénio?
Proposta de resolução
6.1 K c = [
HCN ] ( 0,1)
2 2
Û Kc = = 5,0 ´ 10-3
[ N 2 ] [ C2H 2 ] 1,0 ´ 2,0
6.2 A análise do gráfico permite concluir que o aumento da
temperatura favorece a formação de cianeto de hidrogénio. Como o
número total de moléculas gasosas de ambos os lados da equação
química é o mesmo, o equilíbrio não será afetado por variação de
pressão. A remoção de produto à medida que este se vai formando e
a adição de excesso de um reagente (o nitrogénio, por exemplo, que
pode ser obtido diretamente do ar) também podem aumentar o
rendimento da reação. O processo também será mais rentável com a
utilização de um catalisador adequado dado que este não afeta o
equilíbrio, mas sim a rapidez com que este é atingido.
Exercício resolvido
7. O nitrogénio é um dos principais constituintes de fertilizantes
sintéticos de origem não orgânica. Pode aparecer na forma de
ureia, sulfato de amónio, fosfato de amónio, entre outros, produtos
cuja produção industrial depende do amoníaco como reagente
inicial.
A produção de amoníaco, por sua vez, envolve a reação, em fase
gasosa, entre o nitrogénio, N2, e o hidrogénio, H2, de acordo com a
seguinte equação química:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
A figura ao lado mostra,
aproximadamente, as percentagens de
amoníaco em equilíbrio com o
nitrogénio e hidrogénio, na mistura da
reação de síntese.
7.1 Com base nos dados fornecidos, quais seriam as condições de
pressão e temperatura que favoreceriam a formação de NH3?
Justifique a sua resposta.
7.2 Se a temperatura de 450 °C e a pressão de 1,2 ´ 107 Pa se
obtiveram 50 toneladas de amoníaco, quantas toneladas de
amoníaco seriam obtidas à temperatura de 300 °C e a pressão de
1,6 ´ 107 Pa?
7.3 A presença de um catalisador faz variar a percentagem de
amoníaco na mistura reacional de equilíbrio?
7.1 A síntese de amoníaco é favorecida a baixas temperaturas e
pressões elevadas. De acordo com os dados fornecidos, a pressão
de 2,0 ´ 107 Pa e a temperatura de 300 °C são as condições que
melhor favorecem a formação de NH3.
7.2 A temperatura de 450 °C e à pressão de 1,2 ´ 107 Pa obteve-
se 50 toneladas de amoníaco e a fração molar de amoníaco na
mistura é de 0,20, por leitura do gráfico.
Como à temperatura de 300 °C e à pressão de 1,6 ´ 107 Pa, a
fração molar de amoníaco na mistura é de 0,60 a quantidade de
amoníaco que se obterá nessas condições é:
60 ´ 50
mNH3 = = 150 toneladas
20
7.3 Não, um catalisador apenas acelera a velocidade das reações
direta e inversa mas não interfere no rendimento da reação.
Você também pode gostar
- Manual Treinamento 521dDocumento308 páginasManual Treinamento 521dJulio César Sousa100% (8)
- Cinética QuímicaDocumento31 páginasCinética Químicacristianemoreira.quimicaAinda não há avaliações
- Cinetica QuimicaDocumento9 páginasCinetica QuimicaRubia MariathAinda não há avaliações
- 07 - Dimensionamento de Isoladores Sob Condições de PoluiçãoDocumento115 páginas07 - Dimensionamento de Isoladores Sob Condições de PoluiçãoAlan ZanzeriAinda não há avaliações
- B1 Residencial - Residencial Conv. Monômia - Monofásico: Nome Do ClienteDocumento2 páginasB1 Residencial - Residencial Conv. Monômia - Monofásico: Nome Do ClienteLuana SantosAinda não há avaliações
- Prova de Comandos EletricosDocumento8 páginasProva de Comandos EletricosPedro Nery100% (1)
- Índices de Cálculo de SolosDocumento18 páginasÍndices de Cálculo de SolosJoão QuadrosAinda não há avaliações
- Relatório 6 - Equilíbrio QuímicoDocumento17 páginasRelatório 6 - Equilíbrio QuímicoJanaina100% (5)
- Exercícios Congruência de TriângulosDocumento4 páginasExercícios Congruência de TriângulosGiovanna AAinda não há avaliações
- Eq11 em PPT Modulo 7Documento19 páginasEq11 em PPT Modulo 7germano machadoAinda não há avaliações
- Eq QuímicoDocumento12 páginasEq QuímicoluisaAinda não há avaliações
- PET Complementar Volume 6 (Química) 2º EMDocumento66 páginasPET Complementar Volume 6 (Química) 2º EMAna Elisa Teixeira AlcobaAinda não há avaliações
- Material Química Módulo 5Documento19 páginasMaterial Química Módulo 5barbarasuellenquimicaAinda não há avaliações
- Deslocamento de EquilíbrioDocumento19 páginasDeslocamento de EquilíbriofsinternetAinda não há avaliações
- GE - Físico-Química - 03Documento15 páginasGE - Físico-Química - 03Johny Neres SantanaAinda não há avaliações
- Aula 1 Introdução À Química Analítica - 2012Documento75 páginasAula 1 Introdução À Química Analítica - 2012betowsantosAinda não há avaliações
- FT 2 - EqulíbrioDocumento16 páginasFT 2 - EqulíbrioMartinha LeãoAinda não há avaliações
- Relatório Do Experimento 7 - INLAB de QGDocumento11 páginasRelatório Do Experimento 7 - INLAB de QGmarianne carvalhoAinda não há avaliações
- Reagente LimitanteDocumento6 páginasReagente LimitanteSonia Coelho0% (1)
- Relatório 18 Deslocamento de Equilibrio 02Documento9 páginasRelatório 18 Deslocamento de Equilibrio 02Rodrigo SowaAinda não há avaliações
- Fatores Que Alteram o Equilibrio QuímicoDocumento21 páginasFatores Que Alteram o Equilibrio QuímicoJoão PauloAinda não há avaliações
- 3-Equilíbrio Químico (Apostila)Documento14 páginas3-Equilíbrio Químico (Apostila)Vaniely SiqueiraAinda não há avaliações
- Reacções Analíticas PDFDocumento83 páginasReacções Analíticas PDFCaltonAinda não há avaliações
- 24444450101022quimica I Aula 18Documento12 páginas24444450101022quimica I Aula 18MaSilMen LovadesAinda não há avaliações
- Introdução QuitaDocumento7 páginasIntrodução QuitaEdmilJvDomsCGAinda não há avaliações
- Tema B. Velocidade Das Reacções Químicas E Equilíbrio QuímicoDocumento3 páginasTema B. Velocidade Das Reacções Químicas E Equilíbrio QuímicobaptistajanicengolofiAinda não há avaliações
- 2021 - 03 - 01 19 - 47 Office LensDocumento1 página2021 - 03 - 01 19 - 47 Office LenscarolinaAinda não há avaliações
- Introdução: Reações Químicas ReversíveisDocumento6 páginasIntrodução: Reações Químicas ReversíveisEduarda SantannaAinda não há avaliações
- Relatorio 2 - Equilibrio QuimicoDocumento14 páginasRelatorio 2 - Equilibrio Quimicoemerson_valverde100% (1)
- Resumos - Quimica - 11º - Novo - Programa - 2016Documento10 páginasResumos - Quimica - 11º - Novo - Programa - 2016Margarida FonsecaAinda não há avaliações
- Cromato e DicromatoDocumento9 páginasCromato e DicromatoWolney PiresAinda não há avaliações
- Trabalho de QuimicaDocumento9 páginasTrabalho de QuimicaMarciliaAinda não há avaliações
- 01 Equilíbrio QuímicoDocumento4 páginas01 Equilíbrio QuímicoDiogo DiasAinda não há avaliações
- Equilíbrio QuímicoDocumento13 páginasEquilíbrio QuímicoSilvio RobertoAinda não há avaliações
- Princípio de Le ChatelierDocumento2 páginasPrincípio de Le ChatelierJosy Da CruzAinda não há avaliações
- Relatório de Equilíbrio Químico - UFPADocumento23 páginasRelatório de Equilíbrio Químico - UFPAmarioroca100% (1)
- Equiibrio QuimicoDocumento15 páginasEquiibrio QuimicoAldair FreireAinda não há avaliações
- Apfq05. Equilíbrios MolecularesDocumento18 páginasApfq05. Equilíbrios MoleculareselizaAinda não há avaliações
- 8-Princípio de Le ChâtelierDocumento29 páginas8-Princípio de Le ChâtelierRute FidalgoAinda não há avaliações
- Trabalho de Química 3º ANODocumento9 páginasTrabalho de Química 3º ANOdubequimaoAinda não há avaliações
- Aula 04-EQUILIBRIO QUIMICOSDocumento33 páginasAula 04-EQUILIBRIO QUIMICOSLeonardo Maciel100% (2)
- AppDocumento1 páginaAppafonso kikoAinda não há avaliações
- Apontamento Cinética e Equilíbrio - PauloDocumento1 páginaApontamento Cinética e Equilíbrio - PauloRick EmanuelAinda não há avaliações
- Relatorio de QuimicaDocumento12 páginasRelatorio de QuimicaNicoly MoretoAinda não há avaliações
- Trabalho Quimica Miguel N-21 3DDocumento10 páginasTrabalho Quimica Miguel N-21 3DMiguel Baptista RodriguesAinda não há avaliações
- Apostila 5 - Equilíbrio QuímicoDocumento39 páginasApostila 5 - Equilíbrio QuímicoGustavo MarinhoAinda não há avaliações
- Capítulo Xii - Equilíbrio QuímicoDocumento8 páginasCapítulo Xii - Equilíbrio Químicoryan ferreiraAinda não há avaliações
- Apresentação 6Documento7 páginasApresentação 6Fernanda BonfimAinda não há avaliações
- Equilíbrio Químico - 3° AnoDocumento17 páginasEquilíbrio Químico - 3° AnoJeyciane RosaAinda não há avaliações
- Trabalho Substituitivo de RelatórioDocumento7 páginasTrabalho Substituitivo de RelatórioAgatha Lima FrançoisAinda não há avaliações
- Equilibrio Quimico GrupoDocumento22 páginasEquilibrio Quimico Grupoguerraldo manuel cucha cuchaAinda não há avaliações
- Equilíbrio Químico IDocumento22 páginasEquilíbrio Químico Imarcio.prof.diasAinda não há avaliações
- Relatório Quali EquilíbrioDocumento16 páginasRelatório Quali EquilíbrioAnnelíesi Lopes100% (1)
- Prova de Equilíbrio Mk4Documento3 páginasProva de Equilíbrio Mk4Ariel AraujoAinda não há avaliações
- Química - EquilíbrioDocumento5 páginasQuímica - EquilíbrioEzequiel CalixtoAinda não há avaliações
- ODocumento2 páginasOLany MesquitaAinda não há avaliações
- Equilíbrio QuímicoDocumento10 páginasEquilíbrio QuímicoAbreu Ngongo Filipa KasanjiAinda não há avaliações
- Relatório de Química Experimental - Equilíbrio QuímicoDocumento11 páginasRelatório de Química Experimental - Equilíbrio Químicoanardamasceno0% (1)
- Equilibrio QuimicoDocumento20 páginasEquilibrio QuimicoGiulliano Carlos ThomazAinda não há avaliações
- Deslocamento Do EquilíbrioDocumento2 páginasDeslocamento Do EquilíbrioThuyline DyandraAinda não há avaliações
- Equilibrio QuimicoDocumento30 páginasEquilibrio QuimicoAna Raquel DamacenaAinda não há avaliações
- Relatório Cinética QuímicaDocumento9 páginasRelatório Cinética QuímicaAline FassinaAinda não há avaliações
- Equilíbrio QuímicoDocumento94 páginasEquilíbrio QuímicoMicheleAinda não há avaliações
- Operações Unitárias na Indústria de Alimentos e QuímicaNo EverandOperações Unitárias na Indústria de Alimentos e QuímicaAinda não há avaliações
- F1.1 Tempo, Posição e VelocidadeDocumento17 páginasF1.1 Tempo, Posição e VelocidadedianaAinda não há avaliações
- Q2 1.ácidos e Bases (2. Parte)Documento26 páginasQ2 1.ácidos e Bases (2. Parte)dianaAinda não há avaliações
- Q2 2 Reações de Oxidação-ReduçãoDocumento34 páginasQ2 2 Reações de Oxidação-ReduçãodianaAinda não há avaliações
- 1t 10.º 19 - 20 (R)Documento2 páginas1t 10.º 19 - 20 (R)dianaAinda não há avaliações
- 1f Formativa 10.º 19-20 (R)Documento3 páginas1f Formativa 10.º 19-20 (R)dianaAinda não há avaliações
- 3f Formativa 10.º 19-20 (R)Documento3 páginas3f Formativa 10.º 19-20 (R)dianaAinda não há avaliações
- Regulação Nos Seres Vivos - OsmorregulaçãoDocumento9 páginasRegulação Nos Seres Vivos - OsmorregulaçãodianaAinda não há avaliações
- GlofishDocumento10 páginasGlofishdianaAinda não há avaliações
- Transformação e Utilização de Energia Pelos Seres Vivos - Trocas Gasosas Animais v2020Documento8 páginasTransformação e Utilização de Energia Pelos Seres Vivos - Trocas Gasosas Animais v2020dianaAinda não há avaliações
- Glofish FinalDocumento2 páginasGlofish FinaldianaAinda não há avaliações
- Ogm DebateDocumento6 páginasOgm DebatedianaAinda não há avaliações
- FII 3 Momento de Inercia 2011Documento4 páginasFII 3 Momento de Inercia 2011Ze LimaAinda não há avaliações
- Materiais CerâmicosDocumento23 páginasMateriais CerâmicosFernanda Maria Dias Pacifico SeabraAinda não há avaliações
- Remat ExercicioDocumento4 páginasRemat ExercicioAllen TajuAinda não há avaliações
- NBR - 5410-110 Tabela 37Documento1 páginaNBR - 5410-110 Tabela 37Pedro VolkweisAinda não há avaliações
- 1-Instalações Eléctricas - MateriaisDocumento26 páginas1-Instalações Eléctricas - MateriaisPedro LourençoAinda não há avaliações
- AD1 - Bioquímica I - Lazaro Da CruzDocumento3 páginasAD1 - Bioquímica I - Lazaro Da CruzCOMERCIAL NATURAL ENERGYAinda não há avaliações
- Documento 111Documento3 páginasDocumento 111murilo monkyAinda não há avaliações
- Analista de ControladoriaDocumento4 páginasAnalista de ControladoriaDária CarolinaAinda não há avaliações
- Aula 7 - Classe de CorantesDocumento88 páginasAula 7 - Classe de CorantesLarissa MauricioAinda não há avaliações
- Ref 1Documento188 páginasRef 1lorenachagasvirtualidAinda não há avaliações
- f10 Quad 10ano 2022 23-1Documento5 páginasf10 Quad 10ano 2022 23-1NiffiQAinda não há avaliações
- Lenox Twill - Brocas Mat Alta ResistênciaDocumento12 páginasLenox Twill - Brocas Mat Alta ResistênciapissiniAinda não há avaliações
- Licao 1Documento6 páginasLicao 1Carlos GilAinda não há avaliações
- D31 (Mat. 3 Série) - Blog Do Prof. WarlesDocumento3 páginasD31 (Mat. 3 Série) - Blog Do Prof. WarlesFLAVIA JUSSARA DE SANTANA MENEZESAinda não há avaliações
- Meriva Especificacoes TecnicasDocumento131 páginasMeriva Especificacoes TecnicasGabriel ReisAinda não há avaliações
- IT-A540-010-R00-SET-13 - Içamento e Movimentação de Cargas - CópiaDocumento37 páginasIT-A540-010-R00-SET-13 - Içamento e Movimentação de Cargas - CópiajosetecsegtrabAinda não há avaliações
- Exercícios ReatoresDocumento9 páginasExercícios ReatoresEduardaAinda não há avaliações
- Aula 05 - Estrategias de Projeto - Iluminacao e Conforto Termico - 01-2013 - 20130517233447Documento58 páginasAula 05 - Estrategias de Projeto - Iluminacao e Conforto Termico - 01-2013 - 20130517233447Mariana MolinaAinda não há avaliações
- 04 - CalorimetriaDocumento36 páginas04 - CalorimetriaAndré do freeAinda não há avaliações
- Apostila de Física 3 AnoDocumento33 páginasApostila de Física 3 AnoLuis GustavoAinda não há avaliações
- Ber Exercciosdeaprendizagem9anoDocumento3 páginasBer Exercciosdeaprendizagem9anoSuzane SilvaAinda não há avaliações
- Aquecimento FísicoDocumento6 páginasAquecimento FísicoInês EstevesAinda não há avaliações
- TTH 1 F 6869 EcDocumento3 páginasTTH 1 F 6869 Eceduardoroberto0309Ainda não há avaliações
- Interruptores Linha Duomo SpazioDocumento8 páginasInterruptores Linha Duomo SpazioKleber AugustoAinda não há avaliações