Escolar Documentos
Profissional Documentos
Cultura Documentos
Soluções - Química SSA 2 1911 Scribd
Enviado por
Vinicius Cadete0 notas0% acharam este documento útil (0 voto)
14 visualizações3 páginasEste documento resume as principais características de soluções. Há três tipos de dispersões: solução verdadeira, dispersão coloidal e suspensão. Só a solução verdadeira é homogênea. As soluções podem ser eletrolíticas ou não-eletrolíticas dependendo de sua capacidade de conduzir corrente elétrica. A solubilidade de um soluto pode variar com fatores como temperatura, pressão e agitação.
Descrição original:
Título original
Soluções - Química SSA 2 1911 scribd.txt
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
TXT, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoEste documento resume as principais características de soluções. Há três tipos de dispersões: solução verdadeira, dispersão coloidal e suspensão. Só a solução verdadeira é homogênea. As soluções podem ser eletrolíticas ou não-eletrolíticas dependendo de sua capacidade de conduzir corrente elétrica. A solubilidade de um soluto pode variar com fatores como temperatura, pressão e agitação.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato TXT, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
14 visualizações3 páginasSoluções - Química SSA 2 1911 Scribd
Enviado por
Vinicius CadeteEste documento resume as principais características de soluções. Há três tipos de dispersões: solução verdadeira, dispersão coloidal e suspensão. Só a solução verdadeira é homogênea. As soluções podem ser eletrolíticas ou não-eletrolíticas dependendo de sua capacidade de conduzir corrente elétrica. A solubilidade de um soluto pode variar com fatores como temperatura, pressão e agitação.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato TXT, PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Química SSA 2 - Soluções
As soluções são misturas homogêneas
Solução é um tipo de dispersão (sistemas nos quais
uma substância está disseminada, em forma de partículas,
sobre a outra
Disperso -> soluto
Dispergente -> solvente
Há três tipos de dispersões
Solução verdadeira -> Partículas menor que 1 nanômetro
Dispersão coloidal -> Partículas entre 1 nanômetro e 1000 nanômetros.
Não se distigue a olho nu, mas, através de microscópios potentes, é possível ver
Suspensão -> partículas maiores que 1 nanômetros. Vê-se a olho nu ou com
miscroscópios normais
Ou seja, a solução verdadeira é a unica realmente homogênea
1 Nm equivale a 10 ^-9 metros
As soluções coloidadis nos crecam no dia a dia -> fumaça, creme dental,
desodorante, queijo, sorvete, geléia
Fase de agregação
O solvente determina a fase de agragação (sólido, líquido, gasoso
Condução de corrente elétrica
Soluç~eos formadas por moléculas não conseguem transmoitir corrente elétrica, por
isso são
consideradas Soluções não eletrolíticas
Soluções eletrolítica (iônica) -> consegue fluir uma corrente elétrica, que precisa
necessa´riamente ter íons
Solução diluída -> Pequena quantidade de soluto em relação ao solvente
Solução concentrada -> Quantidade considerável de soluto, mas não atinge a
saturação do solvente
Solubilidade -> Coeficiente de solubilidade é a máxima quantidade de soluto que
pode ser dissolvida
Solução insaturada -> Quantidade de soluto abaixo do coeficiente de solução
Solução saturada -> Máxima quantidade do Coeficiente de soluto sem haver corpo de
fundo
Solução saturada com corpo de fundo -> Solução saturada + corpo de fundo (sobra)
Solução supersaturada -> tem absorvido mais do que o coeficiente de soluto,
aquecendo o produto, dissovendo e depois
baixando lentamente a temperatura para o T original. Porém, a solução super
saturada é extremamamente istável, logo qualquer agitação
faz com que a solução supersaturada passe a ser saturada com corpo de fundo
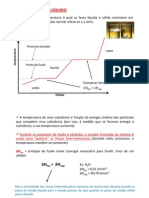
Em gráficos
Na curva -> solução saturada
Acima da curva - Saturada com corpo de fundo ou supersaturada
Abaixo da curva -> Insaturada
Dissoluções endotérmicas e exotérmicas
O aumento da temperatura influi na solubilidade -> são grandeza diretamente
prpopocionais
Dissolção exotérmica -> quando aumenta a temperatura, a solubilidade do soulto
baixa. Grandezas inversamnte
propocionais
No gráfico
Curva crescente da solubilidade em relação `{a temperatura -> endotérmica
Curva descrescente -> Exotérmica
Solubilidade de um gás -> exemplo refrigerante
Maior temperatura = menor solubilidade
Maior pressão = maior solubilidade
maior agitação = menor solubilidade
Ponto de inflexão -> representa a mudança na estrutura do soluto, por exemplo, a
saída de retículos de água
que estava presentes na esturutra do soulto e, quando aquecidos, saem
Conctrações das soluções
Densidade
Título
Você também pode gostar
- Soluções 40Documento19 páginasSoluções 40Alberio Rocha100% (1)
- Processo de Produção de Fertilizantes Fosfatados FINAL - Comentado IS 31 - 05 - 14 (Salvo Automaticamente)Documento61 páginasProcesso de Produção de Fertilizantes Fosfatados FINAL - Comentado IS 31 - 05 - 14 (Salvo Automaticamente)Elisabete Feitosa50% (4)
- Soluções - Química SSA 2 1911Documento3 páginasSoluções - Química SSA 2 1911Vinicius CadeteAinda não há avaliações
- Propriedades ColigativasDocumento27 páginasPropriedades Coligativascristianemoreira.quimicaAinda não há avaliações
- Soluções QuímicasDocumento4 páginasSoluções QuímicasfermcnAinda não há avaliações
- SOLUÇÕESDocumento21 páginasSOLUÇÕESliineesoouzaaAinda não há avaliações
- Soluções e dispersões: tipos e aplicaçõesDocumento29 páginasSoluções e dispersões: tipos e aplicaçõesLuisa DelfinoAinda não há avaliações
- Soluções: Curvas de Solubilidade e ConcentraçõesDocumento32 páginasSoluções: Curvas de Solubilidade e ConcentraçõesRicardo AlvesAinda não há avaliações
- Soluções: tipos, concentrações e cálculosDocumento24 páginasSoluções: tipos, concentrações e cálculosProf. Anderson OliveiraAinda não há avaliações
- Propriedades ColigativasDocumento23 páginasPropriedades ColigativasAnne IngridAinda não há avaliações
- Solubulidade, Coloides e Concentração - 2º ANO - Frente A Cap.2Documento24 páginasSolubulidade, Coloides e Concentração - 2º ANO - Frente A Cap.2Fabio FerrazAinda não há avaliações
- Aula1 SoluçõesDocumento41 páginasAula1 SoluçõesLuana Silva FerreiraAinda não há avaliações
- Mudanças de estado físico e solubilidadeDocumento2 páginasMudanças de estado físico e solubilidadeGuilherme MartinsAinda não há avaliações
- Roteiro de química: dispersão, soluções, colóides e concentraçõesDocumento3 páginasRoteiro de química: dispersão, soluções, colóides e concentraçõesAna Júlia Seniske KrizanoskiAinda não há avaliações
- Quimica 18Documento29 páginasQuimica 18ascatanho100% (1)
- 2 AnoDocumento32 páginas2 Anoestrela_black_02Ainda não há avaliações
- SoluesDocumento12 páginasSoluesMarceloCardosoAinda não há avaliações
- PropriedadescoligativasDocumento33 páginasPropriedadescoligativasRonielson DamascenoAinda não há avaliações
- Soluções 2018 V01Documento102 páginasSoluções 2018 V01RomeuComastriAbdalaAinda não há avaliações
- DISPERSOES Prof. CleberDocumento62 páginasDISPERSOES Prof. CleberceliogardeonAinda não há avaliações
- Siepe AP Quim 2ano Soluções IDocumento2 páginasSiepe AP Quim 2ano Soluções INow UnitedAinda não há avaliações
- Aula Experimental Coeficiente de SolubilidadeDocumento2 páginasAula Experimental Coeficiente de SolubilidadeAstronáuta AstroAinda não há avaliações
- Resumo Sobre SoluçõesDocumento19 páginasResumo Sobre SoluçõesFabíola FelixAinda não há avaliações
- Aula 11 - Notas de AulaDocumento17 páginasAula 11 - Notas de AulaDanielAinda não há avaliações
- SoluçãoDocumento5 páginasSoluçãoBráulio BrazAinda não há avaliações
- Propriedades Coligativas Da Água. Sistemas Dispersos - 2022-2023 - AULA 2Documento40 páginasPropriedades Coligativas Da Água. Sistemas Dispersos - 2022-2023 - AULA 2Dorivaldo GomesAinda não há avaliações
- Curso 11186 Aula 11 v1Documento29 páginasCurso 11186 Aula 11 v1Moises CorsiAinda não há avaliações
- Reações Químicas em Soluções AquosasDocumento13 páginasReações Químicas em Soluções AquosasELMAR JUNIORAinda não há avaliações
- QUÍMICA 2° Ano - SoluçõesDocumento110 páginasQUÍMICA 2° Ano - Soluçõeslcesar2008Ainda não há avaliações
- 4 Solucoes TeoriaDocumento9 páginas4 Solucoes TeoriaIsabela MarcelinoAinda não há avaliações
- Soluções e Propriedades Coligativas - TeoriaDocumento8 páginasSoluções e Propriedades Coligativas - TeoriaAline EvangelistaAinda não há avaliações
- Soluções Teoria e ExercíciosDocumento15 páginasSoluções Teoria e ExercíciosANA RITA MACHADOAinda não há avaliações
- Propriedade QuímicasDocumento13 páginasPropriedade QuímicasEder Cezano GonçalvesAinda não há avaliações
- Soluções - Importância BiofísicaDocumento20 páginasSoluções - Importância BiofísicaRenylson DutraAinda não há avaliações
- Misturas, Soluções e ColóidesDocumento35 páginasMisturas, Soluções e ColóidesFelipe Lopes100% (1)
- Química - SoluçõesDocumento17 páginasQuímica - SoluçõesMiriam_Bleggi_brAinda não há avaliações
- Apostila Físico-Química1Documento29 páginasApostila Físico-Química1Diego E MarinaAinda não há avaliações
- Resumo de Química sobre Estados da Matéria e suas PropriedadesDocumento13 páginasResumo de Química sobre Estados da Matéria e suas PropriedadesAna Luiza Marsilio AlvesAinda não há avaliações
- TonosDocumento8 páginasTonosCYNARA MAIRA JERONIMO DE PAULAAinda não há avaliações
- DispersoesDocumento31 páginasDispersoesCristiane Da Silva SobrinhoAinda não há avaliações
- Aula 02 - 2ºano - SOLUÇÕES - 01 - 2023Documento34 páginasAula 02 - 2ºano - SOLUÇÕES - 01 - 2023Ágata LohanaAinda não há avaliações
- Aula 1Documento46 páginasAula 1celiogardeonAinda não há avaliações
- 2 - Soluções Parte 1Documento23 páginas2 - Soluções Parte 1JuliaAinda não há avaliações
- Química SoluçõesDocumento11 páginasQuímica SoluçõesHellen PatriciaAinda não há avaliações
- Roteiro 1 - Soluções Densidade ConcentraçãoDocumento2 páginasRoteiro 1 - Soluções Densidade ConcentraçãoThiago AcciolyAinda não há avaliações
- Aula de Propriedades Coligativas em Power Point Pronta 23.08.2023Documento26 páginasAula de Propriedades Coligativas em Power Point Pronta 23.08.2023BrunodsAinda não há avaliações
- Misturas e Soluções-Texto ComplementarDocumento6 páginasMisturas e Soluções-Texto ComplementarcaoAinda não há avaliações
- Mistura& Soluções - Mecanismos de DissoluçãoDocumento8 páginasMistura& Soluções - Mecanismos de DissoluçãoTOMAS TITO JOAOAinda não há avaliações
- SOLUÇÕESDocumento44 páginasSOLUÇÕESYasminAinda não há avaliações
- Apresentação1 (2) (1)Documento45 páginasApresentação1 (2) (1)Camila gondimAinda não há avaliações
- Apostila Do 2 Ano Noturno QuimicaDocumento34 páginasApostila Do 2 Ano Noturno QuimicacatilioAinda não há avaliações
- Aula 1Documento108 páginasAula 1Inaê melloAinda não há avaliações
- Soluções verdadeiras ou falsasDocumento70 páginasSoluções verdadeiras ou falsasprofmarconiAinda não há avaliações
- Aula 6 - Dispersões, Soluções e DiluiçõesDocumento20 páginasAula 6 - Dispersões, Soluções e Diluiçõesisabelly santosAinda não há avaliações
- Soluções químicas éDocumento3 páginasSoluções químicas éSAMIR SANTOSAinda não há avaliações
- 1o Reinado - Dom Pedro I e a independência do BrasilDocumento1 página1o Reinado - Dom Pedro I e a independência do BrasilVinicius CadeteAinda não há avaliações
- 1 Guerra Mundial - História TópicosDocumento3 páginas1 Guerra Mundial - História TópicosVinicius CadeteAinda não há avaliações
- Termologia e escalas termométricasDocumento2 páginasTermologia e escalas termométricasVinicius CadeteAinda não há avaliações
- Termodinâmica - Física SSA 2 1611Documento3 páginasTermodinâmica - Física SSA 2 1611Vinicius CadeteAinda não há avaliações
- Exercicio Termoquimica e Cinetica 2Documento4 páginasExercicio Termoquimica e Cinetica 2Vinicius CadeteAinda não há avaliações
- Soluções químicas: tipos, propriedades e fatores que influenciam a solubilidadeDocumento3 páginasSoluções químicas: tipos, propriedades e fatores que influenciam a solubilidadeVinicius CadeteAinda não há avaliações
- Histoira Ssa 2 0110Documento3 páginasHistoira Ssa 2 0110Vinicius CadeteAinda não há avaliações
- Crase SSA 2 PORTUGUÊS 1211Documento2 páginasCrase SSA 2 PORTUGUÊS 1211Vinicius CadeteAinda não há avaliações
- Geometria espacial - Posições relativas entre retas e planosDocumento1 páginaGeometria espacial - Posições relativas entre retas e planosVinicius CadeteAinda não há avaliações
- Agrupamentos Sociais - Sociologia SSA 2 1811Documento2 páginasAgrupamentos Sociais - Sociologia SSA 2 1811Vinicius CadeteAinda não há avaliações
- Gorgonoid - Planilha Completa (LIMPA)Documento16 páginasGorgonoid - Planilha Completa (LIMPA)Vinicius CadeteAinda não há avaliações
- 1 Guerra Mundial - História TópicosDocumento3 páginas1 Guerra Mundial - História TópicosVinicius CadeteAinda não há avaliações
- O Que Foi A Revolução CubanaDocumento1 páginaO Que Foi A Revolução CubanaVinicius CadeteAinda não há avaliações
- O Que Foi A Revolução Cubana?Documento3 páginasO Que Foi A Revolução Cubana?Vinicius CadeteAinda não há avaliações
- Trabalho de Educação Fisica SocorrosDocumento1 páginaTrabalho de Educação Fisica SocorrosVinicius CadeteAinda não há avaliações
- América Latina ComercioDocumento2 páginasAmérica Latina ComercioVinicius CadeteAinda não há avaliações
- Este Relatório É Apresentado Sobre A Excursão Do Colégio Emília Xavier de SouzaDocumento1 páginaEste Relatório É Apresentado Sobre A Excursão Do Colégio Emília Xavier de SouzaVinicius CadeteAinda não há avaliações
- O Que Foi A Revolução Cubana?Documento3 páginasO Que Foi A Revolução Cubana?Vinicius CadeteAinda não há avaliações
- O Que Foi A Revolução Cubana?Documento3 páginasO Que Foi A Revolução Cubana?Vinicius CadeteAinda não há avaliações
- Estudo Comparativo Entre Diferentes Tipos de TubulaçõesDocumento15 páginasEstudo Comparativo Entre Diferentes Tipos de TubulaçõesMariana AnselmoAinda não há avaliações
- Manual de Segurança para LaboratórioDocumento10 páginasManual de Segurança para LaboratórioNayra Maciel100% (1)
- Resumo Sobre Propriedade Dos Gases - IIIDocumento4 páginasResumo Sobre Propriedade Dos Gases - IIIRobson Timoteo DamascenoAinda não há avaliações
- 17834-Texto Do Artigo-70154-1-10-20140624Documento16 páginas17834-Texto Do Artigo-70154-1-10-20140624lu canal do amorAinda não há avaliações
- 23 Resumos de Administracao de Medicamentos EnferresumidaDocumento51 páginas23 Resumos de Administracao de Medicamentos EnferresumidaAbnézerLimadaSilvaAinda não há avaliações
- Anexo III - Planilha de Códigos Do E-Social (Recuperação Automática)Documento1 páginaAnexo III - Planilha de Códigos Do E-Social (Recuperação Automática)Tatiane Barbosa BispoAinda não há avaliações
- Relatório 5 - Índice de IodoDocumento5 páginasRelatório 5 - Índice de IodoMilena SantosAinda não há avaliações
- CaCl2 - NitratoDocumento10 páginasCaCl2 - NitratoMikaele SantosAinda não há avaliações
- Resolução de exercícios de condução e convecção através de paredes planas, cilíndricas e esféricasDocumento12 páginasResolução de exercícios de condução e convecção através de paredes planas, cilíndricas e esféricasfabio_ma0% (1)
- Trabalho de Sintese e Recristalização Do AasDocumento12 páginasTrabalho de Sintese e Recristalização Do AasMatheus AlbuquerqueAinda não há avaliações
- Planejamento Anual 9ºA e 9ºBDocumento5 páginasPlanejamento Anual 9ºA e 9ºBMariana BertheAinda não há avaliações
- UntitledDocumento2 páginasUntitledJuliaAinda não há avaliações
- Inventário de Riscos - PGRDocumento13 páginasInventário de Riscos - PGRDemetrio Barbosa SouzaAinda não há avaliações
- Propriedades das rochas reservatórioDocumento101 páginasPropriedades das rochas reservatórioErika IzianyAinda não há avaliações
- Teoria da geometria molecular baseada na repulsão dos pares de elétrons da camada de valência (VSEPRDocumento5 páginasTeoria da geometria molecular baseada na repulsão dos pares de elétrons da camada de valência (VSEPRGabrielCarneiroAinda não há avaliações
- Exercicios de AprofundamentoDocumento38 páginasExercicios de AprofundamentoJose De Jesus Silva CardosoAinda não há avaliações
- Cálculos estequiométricos reações químicasDocumento11 páginasCálculos estequiométricos reações químicasKetyusciaAinda não há avaliações
- Quadro Modelo IBUTGDocumento2 páginasQuadro Modelo IBUTGapi-3704990100% (3)
- FISPQ Catalisador PU IndustrialDocumento11 páginasFISPQ Catalisador PU IndustrialJorge Henrique Lima JuniorAinda não há avaliações
- TERMODINÂMICA: calor, trabalho e propriedadesDocumento28 páginasTERMODINÂMICA: calor, trabalho e propriedadesAnonymous LuCsZbVlAinda não há avaliações
- Funções Inorgânica2Documento26 páginasFunções Inorgânica2Jaime ChogaAinda não há avaliações
- Química Medicinal ResumoDocumento6 páginasQuímica Medicinal ResumoMariana Moreira NunesAinda não há avaliações
- Lista de Exercício 2 - 2023 ELETROQUIMICA APLICADADocumento1 páginaLista de Exercício 2 - 2023 ELETROQUIMICA APLICADAMarina Gontijo Souza MacedoAinda não há avaliações
- Manual de terminologia e conceitos de manutenção eletromecânicaDocumento32 páginasManual de terminologia e conceitos de manutenção eletromecânicaAnderson GuimarãesAinda não há avaliações
- EPIs para soldadoresDocumento13 páginasEPIs para soldadoresDouglas De Souza BarretoAinda não há avaliações
- C.q.médio LRDocumento6 páginasC.q.médio LRAmanda RezendeAinda não há avaliações
- 8 Tensoes Principais (Cargas Combinadas)Documento11 páginas8 Tensoes Principais (Cargas Combinadas)Eng Felipe Araujo0% (1)
- Termoquímica IntroduçãoDocumento28 páginasTermoquímica IntroduçãoleaorsAinda não há avaliações
- Atividade Tratamentos Térmicos - A3Documento4 páginasAtividade Tratamentos Térmicos - A3Matheus YrionAinda não há avaliações