Escolar Documentos
Profissional Documentos
Cultura Documentos
DHP: Doença Hemolítica Perinatal
Enviado por
Thais Rodrigues de MoraesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
DHP: Doença Hemolítica Perinatal
Enviado por
Thais Rodrigues de MoraesDireitos autorais:
Formatos disponíveis
PROTOCOLO
Doença hemolítica
perinatal
Luciano Marcondes Machado Nardozza1
Descritores ETIOPATOGENIA
Doença hemolítica Aloimunização é a resposta imunológica a um antígeno da mesma espécie.
perinatal; Aloimunização Até o momento, mais de 400 antígenos de superfície foram descritos nas
Rh; Eritroblastose fetal
células vermelhas humanas,(1) muitos dos quais estão implicados na doença
hemolítica perinatal (DHPN) e, por essa razão, são de particular interesse
para a obstetrícia. A exposição a determinado antígeno, seguida da produ-
ção do anticorpo correspondente, ocorre em virtude de algumas variáveis,
dentre as quais sobressai a resposta individual de cada organismo. Assim,
por razões pouco compreendidas, alguns indivíduos, ainda que expostos de
forma repetida a um antígeno estranho, não desenvolvem anticorpos, en-
quanto outros os formam após uma única exposição. Consideram-se como
principais fatores determinantes da imunização: a intensidade do estímulo,
a via de administração, a imunogenicidade do antígeno e a sua frequência
na população. Embora mais de 40 antígenos eritrocitários já tenham sido
associados à DHPN,(2) cumpre ressaltar o papel de destaque do antígeno D,
integrante do sistema Rh, cuja importância clínica reside em sua elevada
imunogenicidade e consequente frequência com que provoca sensibilização
na ausência de medidas profiláticas. O sistema Rh, considerado o mais com-
plexo dos sistemas de grupos sanguíneos, é controlado por dois genes ‒ RHD
e RHCE ‒ localizados em loci e intimamente relacionados, no braço curto do
cromossoma 1. O status positivo ou negativo para o sistema Rh é definido de
acordo com a presença ou ausência, respectivamente, do antígeno D, o que
reflete sua “hegemonia” no sistema. Um indivíduo que possui o antígeno D é
considerado Rh+, ainda que não carregue em suas células vermelhas o alelo
dominante C ou E. As gestantes sensibilizadas por antígenos eritrocitários,
que não pelo fator Rh, apresentam, de maneira geral, melhores resultados
perinatais. É necessário, porém, individualizar os casos, uma vez que o com-
portamento biológico dos diferentes antígenos é diverso.
Como citar?
Nardozza LM. Doença hemolítica
perinatal. São Paulo: Federação
FISIOPATOLOGIA
Brasileira das Associações de Quando um antígeno penetra em um organismo dele desprovido, desen-
Ginecologia e Obstetrícia (Febrasgo);
cadeia, como resposta, uma série de reações que culminam com a pro-
2018. (Protocolo Febrasgo de
Obstetrícia nº 36/Comissão dução de anticorpos específicos contra esse antígeno. A esse fenômeno
Nacional Especializada em Medicina denomina-se imunização. Aloimunização ou isoimunização é a resposta
Fetal). imunológica a um antígeno da mesma espécie e embasa todos os even-
tos da DHPN.(3) O processo se inicia com a penetração de hemácias Rh+
1. Escola Paulista de Medicina, na circulação de mulheres Rh–, com isso, determinando a produção de
Universidade Federal de São Paulo,
São Paulo, SP, Brasil.
anticorpos específicos.(4) Os linfócitos e os macrófagos acham-se envol-
vidos nesse mecanismo de defesa imunológica. O contato da gestante
* Este protocolo foi validado pelos
com sangue incompatível por transfusão, ou quando ocorre passagem
membros da Comissão Nacional transplacentária de sangue fetal para a mãe com feto Rh+ leva à resposta
Especializada em Medicina Fetal imune primária contra o antígeno Rh. A resposta imune primária é lenta,
e referendado pela Diretoria levando de seis semanas até seis meses para acontecer, talvez, pela imu-
Executiva como Documento Oficial
da Febrasgo. Protocolo Febrasgo de
nodepressão característica do estado gravídico, e resulta na produção de
Obstetrícia nº 36, acesse: https:// imunoglobulina do tipo M (IgM), anticorpo de peso molecular 890.000 e
www.febrasgo.org.br/protocolos coeficiente de sedimentação 19 Svedberg (19S). Esse anticorpo não cruza
FEMINA 2020;48(6): 369-74 | 369
Nardozza LM
a barreira placentária e, portanto, não agride o feto. ção consequente principalmente da hipoproteinemia.
Em uma subsequente exposição da mãe ao antígeno Outro efeito da hemólise é o aumento na produção da
Rh, rápidas respostas celular e humoral deflagram-se, bilirrubina do tipo não conjugado, que é transportada
com produção especificamente de anticorpos anti-Rh no plasma ligada à albumina. A bilirrubina não agride
do tipo IgG, que são moléculas pequenas com peso o feto, desse modo, não se verifica icterícia intraútero
molecular de 160.000 e coeficiente de sedimentação mesmo nos casos graves da doença, pois o pigmento é
7S, que cruzam a placenta, indo aderir à membrana do metabolizado pelo fígado materno. Após o parto, a si-
eritrócito Rh+ e causando hemólise fetal.(4) tuação é drasticamente alterada pelo desaparecimento
Alcançada a circulação fetal, os anticorpos ficam ad- repentino do compartimento materno, eficiente depó-
sorvidos à superfície das hemácias portadoras de seu sito de bilirrubina. Assim, julga-se, no epílogo dessas
antígeno específico. Os monócitos do sistema retículo- considerações, que os problemas relacionados ao feto
-endotelial, através dos receptores Fc, reconhecem as e ao recém-nascido atingidos pela doença hemolítica,
hemácias assim sensibilizadas, e o complexo antíge- são basicamente dois: a anemia e suas consequências
no-anticorpo é, então, eritrofagocitado, principalmen- intraútero e a anemia e a hiperbilirrubinemia após o
te no baço. O feto procura compensar a destruição de parto (Figura 1).
suas hemácias pelo incremento na eritropoiese me-
dular e, mais tardiamente, pelo aparecimento de fo-
cos extramedulares de eritropoiese no fígado, baço, ROTEIRO PROPEDÊUTICO
rins e placenta. Isso leva à hepatoesplenomegalia e Anamnese
ao aparecimento de células imaturas, principalmente Os antecedentes obstétricos são de extremo valor, des-
reticulócitos e eritroblastos, circulando no sangue pe- tacando-se a presença de icterícia ou transfusões no
riférico, por isso, justificando o termo “eritroblastose período neonatal, transfusões intrauterinas ou hidro-
fetal”. Quando o processo atinge intensidade suficiente pisia fetal.(6) Há correspondência entre o histórico das
para a velocidade de hemólise superar à de formação gestações e o grau de comprometimento fetal em 62%
de novas células sanguíneas, instala-se a anemia. A dos casos. Também é de suma importância o relato da
persistência do processo hemolítico gera hepatome- necessidade de reposição sanguínea pela paciente de-
galia crescente, ocasionando alteração na circulação vido à possibilidade de transfusões de tipos incompa-
hepática com hipertensão portal; concomitantemente, tíveis. Vários autores chamaram atenção para o uso de
a função do hepatócito é afetada, provocando hipoal- drogas injetáveis como forma cada dia mais frequente e
buminemia. Tal associação pontua o início do apareci- perigosa de sensibilização materna.(7)
mento da ascite. A difusão prejudicada dos aminoáci-
dos, combinada com a síntese de proteína diminuída
Determinação do tipo sanguíneo
pelo hepatócito, resulta em hipoproteinemia grave
com anasarca, caracterizando a hidropisia.(5) Embora a Tipagem sanguínea materna: Toda gestante deve ser
anemia grave possa causar insuficiência cardíaca con- submetida à investigação do tipo sanguíneo Rh. Res-
gestiva e, assim, resultar em hidropisia fetal, estudos salta-se que, em algumas ocasiões, o fenótipo (tipagem
em neonatos hidrópicos demonstram ser essa condi- sanguínea) pode não corresponder à genotipagem.
Anticorpos IgG Passagem transplacentária
Hemólise ↑ Pigmento biliar no líquido amniótico
↑ Débito cardíaco
↓ Viscosidade
Eritroblastose Anemia
Eritropoiese extramedular Hipóxia
Anemia Disfunção hepática Placenta Lesão endotelial
Hipoproteinemia
↑ PAN Falência cardíaca Ascite Plasma no extravascular
↑ Líquido amniótico Hidropisia
Figura 1. Esquema 1 – Representação esquemática da fisiopatologia da aloimunização Rh
370 | FEMINA 2020;48(6): 369-74
Doença hemolítica perinatal
Tipagem sanguínea paterna: Nas gestantes Rh–, o Determinação do Rh fetal
risco de sensibilização ocorre quando o pai é Rh+. A zi-
O DNA fetal pode ser detectado a partir de cinco sema-
gotagem do parceiro é um exame opcional, geralmente
nas de gestação. Inicialmente, é oriundo da apoptose
indicado em casos de maior gravidade.
do sinciciotrofoblasto e, posteriormente, pela passagem
do substrato cromossômico, resultante da lise celular
Pesquisa dos anticorpos antieritrocitários do concepto pela barreira placentária.(12) Em contraste
(teste de Coombs indireto – CI) com a célula fetal ‒ que pode perdurar na circulação
Em 1945, Coombs, Mourant e Race(8) descreveram o teste sanguínea e nos tecidos maternos por tempo prolonga-
da antiglobulina, que simplificou a detecção e a quan- do, o DNA fetal tem meia-vida média de 15 minutos(13) e é
tificação da aloimunização. A pesquisa de anticorpos detectado até as primeiras 24 horas pós-parto. Devido à
irregulares, por meio do teste de CI, deve ser realizada sua rápida degradação, a utilização do DNA fetal aumen-
para todas as gestantes. Na Universidade Federal de São ta a sensibilidade dos testes, minimizando a contamina-
Paulo (Unifesp), por questões financeiras, recomenda-se ção por gestações prévias.(14)
que só se realize o Coombs nas gestantes Rh+ quanto há As proteínas que expressam o antígeno D são cha-
mau passado obstétrico ou transfusão ou uso de drogas. madas de RhD, com diferenças de outras proteínas re-
Essa dosagem deve ser realizada na primeira visita pré- lacionadas a antígenos eritrocitários, sobretudo nas se-
-natal e repetida na 28ª semana de gestação, embora quências dos éxons 4, 5, 7 e 10. Chinen et al.,(15) em 2010,
haja evidência de que anticorpos detectados apenas no encontraram sensibilidade de 100% para a detecção do
terceiro trimestre não causem DHPN. Rh fetal no sangue materno utilizando o éxon 7 e a as-
A sensibilização materna só é caracterizada quando sociação dos éxons 7 e 10.
esse exame é positivo, isto é, existem anticorpos an-
tieritrocitários na circulação materna. Nessa situação Ultrassonografia
é imprescindível a realização do painel de anticorpos É um método propedêutico pouco sensível para predi-
irregulares visando à definição do(s) antígeno(s) en- zer os estados anêmicos do concepto, detectando-os
volvidos. Nos casos em que o resultado é negativo, a apenas nos estados avançados. Seu maior objetivo é
gestante é considerada de risco para a sensibilização, o rastreamento de sinais que possam sugerir o início
sendo orientada a realizar a profilaxia ante e pós-natal, da descompensação fetal a caminho da hidropsia. Os
como descrito, a seguir, no subtítulo Profilaxia. Quando achados mais importantes são: aumento do líquido am-
for caracterizada a DHPN por CI positivo, esta só terá niótico, ascite incipiente (halo anecogênico ao redor da
repercussão clínica importante quando a titulação for bexiga e vesícula biliar, derrame pericárdico e, nos fetos
superior ou igual a 1:16, visto que níveis inferiores a esse masculinos, aumento da hidrocele), aumento da espes-
não oferecem risco de anemia moderada ou severa na sura placentária e surgimento de áreas de maior eco-
grande maioria dos casos. É um teste inespecífico e de- genicidade dispersas pelo parênquima (representando
tecta a presença de IgG antieritrocitária; a especificida- a substituição do tecido placentário por tecido hema-
de em predizer os estados anêmicos graves é de 65%, topoiético extramedular). A hidropisia fetal, grau máxi-
principalmente, com títulos superiores a 1/128. mo de comprometimento do concepto, é caracterizada
por pelo menos dois derrames serosos (ascite, derra-
Espectrofotometria do líquido amniótico me pericárdico ou derrame pleural) acompanhados de
edema de pele. O ecografista que acompanha gestantes
Visa à quantificação dos pigmentos biliares liberados na
aloimunizadas deve investigar sinais premonitórios da
diurese fetal, cujos níveis são proporcionais à hemólise.
hidropsia, visando detectar a melhor época para ini-
O líquido amniótico é avaliado pela técnica de espectofo-
ciar os procedimentos invasivos, como cordocentese e
tometria. Provavelmente, a passagem da bilirrubina não
transfusão intrauterina, com isso melhorando o prog-
conjugada (aumentada pela hemólise) para o líquido am-
nóstico perinatal.
niótico resulta da transudação pelos vasos fetais da su-
perfície placentária e também pelos pulmões e traqueia.
Até há menos de uma década, o acompanhamento de Dopplervelocimetria
gestantes aloimunizadas com risco para DHPN consistia Nas patologias que determinam anemia fetal, como a
na realização de amniocentese seriada, a cada duas a aloimunização Rh, a avaliação pela dopplervelocimetria
três semanas, para determinação de desvios na densi- baseia-se no preceito fisiológico do aumento da veloci-
dade óptica do líquido amniótico a 450 nm, até que ela dade média da coluna de sangue advinda do aumento
atingisse o percentil 80 da zona 2 da curva de Liley(9) para do trabalho cardíaco e da diminuição da viscosidade san-
idades gestacionais maiores que 28 semanas. Atualmen- guínea devida à diminuição dos elementos figurados. A
te, com o advento da dopplervelocimetria, esse método avaliação do pico de velocidade sistólica na artéria ce-
está cada vez mais em desuso. Nardozza et al.(10,11) mostra- rebral média (PVS-ACM), pela dopplervelocimetria, apre-
ram a superioridade do uso do Doppler na detecção da senta vantagens no diagnóstico da anemia fetal, quan-
anemia fetal quando comparado à espectrofotometria. do comparada com a análise do líquido amniótico pela
FEMINA 2020;48(6): 369-74 | 371
Nardozza LM
espectrofotometria, como já foi demonstrado por vários dor da 28ª semana e, caso permaneça negativo, faz-se a
autores.(11,16) Esses estudos mostraram que a dopplervelo- profilaxia antenatal com Ig anti-D. A conduta obstétrica
cimetria é o método mais eficaz, seguro, não invasivo e deverá ser tomada baseada em outros parâmetros clíni-
de fácil repetição, fornece de imediato o resultado, por cos e obstétricos. Cabe lembrar que, após a ministração
ser um método direto, e é o de eleição na aloimuniza- da Ig anti-D, a pesquisa de anticorpos antieritrocitários
ção Kell, em que a anemia ocorre principalmente por de- pode permanecer positiva, porém em títulos baixos.
pleção medular, em vez de hemólise. Vários vasos foram Nas gestantes sensibilizadas, isto é, com teste de CI
propostos e estudados por inúmeros autores, como a ar- maior ou igual a 1:16, deve-se fazer o acompanhamento
téria aorta, esplênica, carótida, umbilical, o duto venoso, por meio da análise dopplervelocimétrica do PVS-ACM.
a veia cava inferior e veia umbilical, entre outros. Mari et A manutenção da normalidade na dopplervelocimetria
al. (1995)(17) demonstraram que a artéria cerebral média e provas de vitalidade preservadas são fatores que não
fornece resposta rápida à hipoxemia, fácil visualização no influenciarão na conduta obstétrica a ser tomada e po-
ângulo 0o, menor variabilidade intra e interobservador e de-se levar a gestação a termo, visto que as gestantes
técnica difundida entre os ultrassonografistas. apresentam baixo risco para anemia moderada ou grave.
Mari et al. (1995) mostraram que, por meio da aná- Nos fetos, contudo, que apresentam velocidades de
lise do PVS-ACM, houve redução em 70% dos testes artéria cerebral média acima de 1,5 múltiplo de media-
invasivos, mas ressaltam que a técnica adequada e o na, com idades gestacionais superiores a 34 semanas, o
correto treinamento do examinador são fundamentais. parto deve ser imediato.
Cabe lembrar, ainda, que, após a 35ª semana de ges- Diante de fetos imaturos (abaixo de 34 semanas), com
tação, na vigência de alguns medicamentos, diante da alterações de dopplervelocimetria (pico de velocidade
excessiva movimentação ou repouso fetal prolongado, a sistólica > 1,5 múltiplo de mediana), sinais de hidropisia
sensibilidade do método é reduzida. Outro fator muito fetal ou mesmo ascite isolada, devem ser feitos a cor-
importante a lembrar é a análise do PVS-ACM após a docentese, a análise do sangue fetal e, diante do resul-
transfusão intrauterina. Scheier et al.(18) mostraram uma tado, o imediato tratamento intrauterino, que se baseia
redução da sensibilidade para 58% após uma transfusão na transfusão intravascular. Anemia fetal grave pode
e para 36% após duas transfusões. ser definida como hematócrito abaixo de 30% ou dois
Como já mencionado, três mensurações da velocida- desvios-padrão abaixo da média do hematócrito para
de do pico sistólico são obtidas e a maior é registrada. a idade gestacional, devendo ser indicado tratamento
Quando o PVS-ACM apresenta valores acima de 1,5 múl- pelo risco de desenvolvimento de insuficiência cardíaca
tiplo da mediana para a idade gestacional correspon- fetal. A antecipação do parto deve ocorrer próximo a 34
dente, estamos diante da anemia moderada ou grave, semanas com o uso de ciclo de corticoide materno an-
com sensibilidade de 100%, segundo vários autores. tes do nascimento.
A frequência e os intervalos de exames dopplervelo- Em razão da baixa frequência de aloimunização por
métricos ainda não estão bem estabelecidos na literatu- outros anticorpos do sistema Rh (C, c, E, e) e anticorpos
ra. A manutenção da normalidade do PVS-ACM (valores não Rh, faltam na literatura protocolos específicos, re-
inferiores a 1,5 múltiplo da mediana) na dopplervelo- comendando-se que nesses raros casos seja seguido o
cimetria é fator importante na presunção de ausência algoritmo usado na aloimunização RhD.(19,20)
de anemia pronunciada, e a gestação pode ser levada Com exceção da aloimunização RhD, não há estraté-
a termo. gias específicas para profilaxia. É possível sempre ado-
Nos fetos cujo PVS-ACM é acima de 1,5 múltiplo de tar medidas gerais que minimizem o risco de troca san-
mediana, com idades gestacionais superiores a 34 se- guínea entre o feto e a mãe no período antenatal, dessa
manas, o parto deve ser imediato. Diante de fetos ima- forma evitando procedimentos invasivos no feto e seus
turos com alterações de dopplervelocimetria, sinais de anexos, bem como manobras de versão externa. Já no
hidropisia fetal ou mesmo ascite isolada, devem ser fei- parto, dever-se-ia procurar realizá-lo pela via vaginal,
tos a cordocentese, a análise do sangue fetal e, diante não fazer uso excessivo de ocitocina, realizar amnioto-
desse resultado, o imediato tratamento intrauterino. mia oportuna, evitar a remoção manual da placenta e
não manter o clampeamento do cordão umbilical en-
ACOMPANHAMENTO E CONDUTA OBSTÉTRICA quanto se aguarda a dequitação.(21)
As gestantes Rh– não sensibilizadas devem realizar a
genotipagem fetal. Aquelas cujos fetos são Rh– não ne- TRANSFUSÃO INTRAUTERINA
cessitam receber a Ig anti-D na 28a semana e terão seu O advento da funiculocentese representou grande pro-
parto no termo, salvo intercorrências clínicas ou obsté- gresso para a avaliação e o tratamento dos fetos aco-
tricas. Aquelas cujos fetos são Rh+ realizarão a pesquisa metidos pela DHPN, pois propicia quantificar e tratar, de
de anticorpos antieritrocitários. forma mais efetiva, a anemia fetal. A introdução desse
Nas gestações com teste de CI negativo, sem história procedimento promoveu o desenvolvimento da técnica
de sangramento, sugere-se a repetição do exame ao re- de transfusão intravascular. Essa modalidade terapêu-
372 | FEMINA 2020;48(6): 369-74
Doença hemolítica perinatal
tica passou a ser a mais utilizada no tratamento da que o marido seja Rh+ ou com tipagem indeterminada.
anemia grave, ocupando, então, o lugar da transfusão Aplica-se a droga por via intramuscular, em dose que
intraperitoneal. A transfusão intravascular é, sem dúvi- varia de 250 a 300 µg no Brasil:
da, o tratamento da forma grave da DHPN, dessa for- • Com 28 semanas de gestação;
ma evitando a morte intrauterina. A via preferencial é
• Nas primeiras 72 horas depois do parto ou
a intravascular, que tem como vantagens a correção
até 28 dias, (3) em caso de omissão ou falta
mais rápida e fisiológica da anemia, o acesso aos pa-
do produto, desde que o recém-nascido seja
drões hematimétricos e a estimativa da época da pró-
Rh+ ou D fraco, apresente teste de Coombs
xima transfusão, baseando-se na taxa diária de queda
direto (CD) negativo e que o parto ocorra
do hematócrito. Soma-se a isso a maior incidência de
após três semanas da primeira dose;
complicações para a via intraperitoneal. A transfusão
intravascular pode ser realizada a partir de 18 até 34 • Em casos de abortamento, gestação molar
semanas de gravidez. O sangue utilizado é concentrado ou ectópica, sangramentos genitais e trauma
com hematócrito entre 65% e 85%, do tipo 0 Rh negativo, abdominal na gravidez, biópsia de vilo corial,
submetido à irradiação (para a destruição de leucócitos amniocentese, funiculocentese, versão cefálica
e diminuição de reação enxerto-hospedeiro), com ve- externa ou feto morto, todas com Rh–, CI negativo
locidade de infusão em torno de 5 a 10 mL/min. A taxa e parceiro Rh+ ou desconhecido recebem
de complicações advindas da transfusão intravascular é profilaxia com 250 µg de anti-D intramuscular,
preferencialmente nas primeiras 72 horas
da ordem de 2% e entre as mais comuns estão a bradi-
após o evento, reaplicada a cada 12 semanas
cardia, a hipercapnia, o tamponamento ou o hematoma
naquelas que se mantenham grávidas;
do cordão por extravasamento de sangue para a geleia
de Wharton, o sangramento para o líquido amniótico e • Em não gestantes, Rh–, não sensibilizadas e
a embolia. transfundidas inadvertidamente com sangue
Rh+, administram-se 12 µg de anti-D para cada
mililitro de sangue incompatível. Quando se
PROFILAXIA
necessita do emprego de mais de cinco ampolas,
A partir de 1968, a Food and Drug Administration (FDA) a dose deve ser fracionada a cada 24 horas. Para
dos Estados Unidos aprovou a utilização da Ig anti-D transfusões incompatíveis acima de 900 mL,
profilaticamente após o parto, com 300 mcg de IgG em homens ou mulheres com prole constituída,
anti-D entre 72 horas até 28 dias, ressaltando-se que nada deve ser feito. Naquelas que desejam
quanto menor o intervalo entre o evento e a aplicação engravidar, entretanto, deve ser feita inicialmente
da profilaxia, maior a eficácia.(22) Desde então, o risco de exossanguineotransfusão de 1,5 volume, com
sensibilização nas mães que deram à luz fetos Rh+ e ABO sangue ABO compatível, Rh–, seguida de aplicação
compatíveis caiu de 16% nas que não recebiam a profila- de anti-D na dose suficiente para neutralizar 25%
xia para 1,5% a 2% naquelas tratadas, quando avaliadas do volume de sangue incompatível transfundido.
até seis meses após o parto. O percentual remanescente
de falha da Ig deve-se provavelmente à ocorrência da REFERÊNCIAS
sensibilização durante a gravidez ou pela atuação de 1. Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Gilstrap L,
anticorpos menos frequentes que não o D, em que não Wenstrom KD. Williams obstetrics. 23nd ed. New York: McGraw-Hill;
há ação da gamaglobulina. Visando diminuir ainda mais 2005.
essa incidência, Bowman et al.,(23) em 1978, propuseram 2. Moise KJ Jr. Non-anti-D antibodies in red-cell alloimmunization. Eur
J Obstet Gynecol Reprod Biol. 2000;92(1):75-81.
a profilaxia antenatal, aplicando uma dose adicional de
3. Braga LF. Prevenção da doença hemolítica perinatal no recém-
300 mcg de Ig anti-D na 28a semana de gestação.
nascido. Femina. 1978;6:394-400.
Em recente revisão sistemática da Fundação Cochra-
4. Peddle LJ. The antenatal management of the Rh sensitized woman.
ne,(24) foi apontada a efetividade da profilaxia pós-natal Clin Perinatol. 1984;11(2):251-6.
da aloimunização Rh com anti-D, reduzindo a ocorrência 5. Rote NS. Pathophysiology of Rh isoimmunization. Clin Obstet
de sensibilização para 1,5%, porém as evidências foram Gynecol. 1982;25(2):243-53.
consideradas limitadas para se recomendar qual seria a 6. Management of isoimmunization in pregnancy. ACOG Technical
Bulletin number 148 – October 1990. Int J Gynaecol Obstet.
dose ótima a ser aplicada (grau B de recomendação). A
1992;37(1):57-62.
cobertura profilática obtida no pós-parto não foi subs-
7. Bowman JM. Hemolytic disease (Erythroblastosis Fetalis). In: Creast
tancialmente diferente quando doses de 100, 200 ou 300 RK, Resnick R, Greene MF, Iams JD, Lockwood CJ, Moore TR, editors.
mg de imunoglobulina anti-D foram administradas. Do- Creasy and Resnik’s Maternal-Fetal Medicine: Principles and
ses menores que 50 mg de anti-D mostraram-se menos Practice. 7th ed. Philadelphia: Elsevier Saunders; 1999. cap. 43, p.
736-82.
efetivas.(25)
8. Coombs RR, Stoker MG. Detection of Q fever antibodies by the anti-
A condição para a aplicação da Ig anti-D na profilaxia globulin sensitization test. Lancet. 1951;2(6671):15-7.
da aloimunização na gestação é que a mulher seja Rh–, 9. Liley AW. Intrauterine transfusion of foetus in haemolytic disease.
não possua anticorpos anti-D (teste de CI negativo) e BMJ. 1963;2(5365):1107-9.
FEMINA 2020;48(6): 369-74 | 373
Nardozza LM
10. Nardozza LM, Camano L, Moron AF, da Silva Pares DB, Chinen PA, 18. Scheier M, Hernandez-Andrade E, Fonseca EB, Nicolaides
Torloni MR. Pregnancy outcome for Rh-alloimmunized women. Int J KH. Prediction of severe fetal anemia in red blood cell
Gynaecol Obstet. 2005;90(2):103-6. alloimmunization after previous intrauterine transfusions. Am J
11. Nardozza LM, Moron AF, Araujo Júnior E, Camano L, Chinen PA, Obstet Gynecol. 2006;195(6):1550-6.
Torloni MR. Rh alloimmunization: doppler or amniotic fluid 19. Schumacher B, Moise KJ Jr. Fetal transfusion for red blood cell
analysis in the prediction of fetal anemia? Arch Gynecol Obstet. alloimmunization in pregnancy. Obstet Gynecol. 1996;88(1):137-50.
2007;275(2):107-11. 20. Monteiro MA, Feferbaum R, Diniz EM, Erico C, Etzel MH, Krebs
12. Khosrotehrani K, Wataganara T, Bianchi DW, Johnson KL. Fetal VL, et al. Aspectos imunohematológicos, genéticos e clínicos a
cell-free DNA circulates in the plasma of pregnant mice: relevance aloimunização por anticorpo anti-c. Relato de dois casos. Pediatria
for animal models of fetomaternal trafficking. Hum Reprod. (São Paulo). 1996;18:95-8.
2004;19(11):2460-4. 21. Lobo GA, Nardozza LM, Camano L. Non-anti-D antibodies in red-cell
13. Lo YM, Tein MS, Lau TK, Haines CJ, Leung TN, Poon PM, et al. alloimmunization. Int J Gynaecol Obstet. 2006;94(2):139-40.
Quantitative analysis of fetal DNA in maternal plasma and serum: 22. Bowman JM. Controversies in Rh prophylaxis. Who needs Rh
implications for noninvasive prenatal diagnosis. Am J Hum Genet. immune globulin and when should it be given? Am J Obstet
1998;62(4):768-75. Gynecol. 1985;151(3):289-94.
14. Lo YM, Zhang J, Leung TN, Lau TK, Chang AM, Hjelm NM. Rapid 23. Bowman JM, Chown B, Lewis M, Pollock JM. Rh isoimmunization
clearance of fetal DNA from maternal plasma. Am J Hum Genet. during pregnancy: antenatal prophylaxis. Can Med Assoc J.
1999;64(1):218-24. 1978;118(6):623-7.
15. Chinen PA, Nardozza LM, Martinhago CD, Camano L, Daher S, Pares DB, 24. Crowter C, Middleton P. Anti-D administration after child birth for
et al. Noninvasive determination of fetal Rh blood group, D antigen preventing Rhesus alloimmunization. Oxford: The Cochrane Library;
status by cell-free DNA analysis in maternal plasma: experience in a 2008.
Brazilian population. Am J Perinatol. 2010;27(10):759-62.
25. Controlled trial of various anti-D dosages in suppression of Rh
16. Oepkes D. Invasive versus non-invasive testing in red-cell sensitization fol-lowing pregnancy. Report to the Medical Research
alloimmunized pregnancies. Eur J Obstet Gynecol Reprod Biol. Council by the working party on the use of anti-D-immunoglobulin
2000;92(1):83-9. for the prevention of isoimmunization of Rh-negative women
17. Mari G, Adrignolo A, Abuhamad AZ, Pirhonen J, Jones DC, during pregnancy. BMJ. 1974;2(5910):75-80.
Ludomirsky A, et al. Diagnosis of fetal anemia with Doppler
ultrasound in the pregnancy complicated by maternal blood group
immunization. Ultrasound Obstet Gynecol. 1995;5(6):400-5.
374 | FEMINA 2020;48(6): 369-74
Você também pode gostar
- Genética Aula 3Documento23 páginasGenética Aula 3Tayná AmaralAinda não há avaliações
- Introdução à eritroblastose fetal e seus aspectos fisiopatológicosDocumento22 páginasIntrodução à eritroblastose fetal e seus aspectos fisiopatológicosCatia Lana Oliveira100% (1)
- Doença Hemolítica Recém-NascidoDocumento4 páginasDoença Hemolítica Recém-NascidoPriscila Siqueira100% (1)
- Curso de Biomedicina Artigo de Revisão: LKLKLKDocumento7 páginasCurso de Biomedicina Artigo de Revisão: LKLKLKErika SantiagoAinda não há avaliações
- Eritroblastose Fetal 01 de MarçoDocumento16 páginasEritroblastose Fetal 01 de MarçoGeremias MangoAinda não há avaliações
- Eritroblastose FetalDocumento5 páginasEritroblastose FetalSidney Gomes100% (2)
- Artigo - Imunohematologia Dos Grupos SangüíneosDocumento8 páginasArtigo - Imunohematologia Dos Grupos SangüíneosaarbsAinda não há avaliações
- Isoimunização, WordDocumento11 páginasIsoimunização, WordDiogo Bento LimaAinda não há avaliações
- Eritroblastose FetalDocumento4 páginasEritroblastose FetalfernandofeltrinAinda não há avaliações
- Eritrosblatose Fetal 2.Documento9 páginasEritrosblatose Fetal 2.Duana GalanteAinda não há avaliações
- Doença HemolíticaDocumento47 páginasDoença HemolíticaRoosevelt PazAinda não há avaliações
- Eritroblastose FetalDocumento40 páginasEritroblastose FetalCatia Lana Oliveira100% (5)
- DHPN - Doença Hemolítica PerinatalDocumento30 páginasDHPN - Doença Hemolítica PerinatalHumberto Lima VieiraAinda não há avaliações
- Atividade Da AndreaDocumento7 páginasAtividade Da Andreajulia.mariactAinda não há avaliações
- Do Cum en ToDocumento3 páginasDo Cum en TodenisedasilvaAinda não há avaliações
- A Eficácia Da Utilização Do Soro Antiglobulina Humana Anti-D Na Prevenção Da Eritroblastose FetalDocumento9 páginasA Eficácia Da Utilização Do Soro Antiglobulina Humana Anti-D Na Prevenção Da Eritroblastose Fetalfabio constancio almeida dfa silvaAinda não há avaliações
- Prevenção da anemia fetal e isoimunizaçãoDocumento6 páginasPrevenção da anemia fetal e isoimunizaçãocatya samajoAinda não há avaliações
- Estudos Dirigidos - Imuno Hematologia e Banco de SangueDocumento15 páginasEstudos Dirigidos - Imuno Hematologia e Banco de SangueRaíssa AbreuAinda não há avaliações
- Isoimunização RH Materna. Profilaxia, Diagnóstico e Tratamento: Aspectos AtuaisDocumento20 páginasIsoimunização RH Materna. Profilaxia, Diagnóstico e Tratamento: Aspectos Atuaisfabio constancio almeida dfa silvaAinda não há avaliações
- 14 ISOINMUNIZACION RH PortuguesDocumento13 páginas14 ISOINMUNIZACION RH PortuguesHeldino Jacob ManuelAinda não há avaliações
- Eritroblastose Fetal WikiDocumento2 páginasEritroblastose Fetal WikiLuciano OlivaAinda não há avaliações
- Incompatibilidade Rh e doença hemolítica neonatalDocumento10 páginasIncompatibilidade Rh e doença hemolítica neonatalw272856Ainda não há avaliações
- Eritroblastose Fetal - FazendoDocumento15 páginasEritroblastose Fetal - FazendomillayforAinda não há avaliações
- Doença Hemolitica SlidesDocumento34 páginasDoença Hemolitica SlidesBerenice Leite100% (1)
- Incompatibilidade Sanguínea Rh: Conceitos e DiagnósticoDocumento3 páginasIncompatibilidade Sanguínea Rh: Conceitos e DiagnósticoMarcelino SiqueiraAinda não há avaliações
- ImunologiaDocumento15 páginasImunologiaGabriella WeidleAinda não há avaliações
- Lupus EritematosoDocumento9 páginasLupus EritematosoMaria Eduarda Cunha SilvaAinda não há avaliações
- VHS, PCR, Leucograma, Uroanálise, Eritrograma, Anemias, Coombs, VDRL e Grupos SanguíneosDocumento48 páginasVHS, PCR, Leucograma, Uroanálise, Eritrograma, Anemias, Coombs, VDRL e Grupos SanguíneosYuri AraújoAinda não há avaliações
- Tdes 2 - Imuno Hematologia e Banco de SangueDocumento30 páginasTdes 2 - Imuno Hematologia e Banco de SangueRaíssa AbreuAinda não há avaliações
- INCOMPATIBILIDADE DE RHDocumento4 páginasINCOMPATIBILIDADE DE RHMurilo NevesAinda não há avaliações
- Doença HemolíticaDocumento47 páginasDoença HemolíticaAmanda AlcureAinda não há avaliações
- Doença Hemolitica Do RNDocumento47 páginasDoença Hemolitica Do RNantoniodidaAinda não há avaliações
- Fechamento 2 Tutoria UC17Documento8 páginasFechamento 2 Tutoria UC17maryypdiasAinda não há avaliações
- DHPN causada por aloimunização RhDDocumento15 páginasDHPN causada por aloimunização RhDPolyanne BarrosAinda não há avaliações
- 16 Doenca Hemolitica Do Recem NascidoDocumento8 páginas16 Doenca Hemolitica Do Recem NascidoAlbertson DalahAinda não há avaliações
- Reações transfus. imediatasDocumento14 páginasReações transfus. imediatasJackson QueirozAinda não há avaliações
- Ficha Informativa - O Sistema RH de Grupos SanguíneosDocumento3 páginasFicha Informativa - O Sistema RH de Grupos SanguíneosSandra Pinheiro PereiraAinda não há avaliações
- Ictericia Neonatal 8eb325e7fb63fa7a2acbd526df2c643dDocumento19 páginasIctericia Neonatal 8eb325e7fb63fa7a2acbd526df2c643dcristiana paisAinda não há avaliações
- Gestão da qualidade em distúrbios hemorrágicos neonataisDocumento6 páginasGestão da qualidade em distúrbios hemorrágicos neonataisFrederico CarvalhoAinda não há avaliações
- DECHT: Guia para irradiação de hemocomponentes na doença enxerto contra hospedeiro transfusionalDocumento12 páginasDECHT: Guia para irradiação de hemocomponentes na doença enxerto contra hospedeiro transfusionalIasmim MaiaraAinda não há avaliações
- S. RhesusDocumento25 páginasS. RhesusEmílio OlímpioAinda não há avaliações
- Hemoparasitoses Caes GatosDocumento24 páginasHemoparasitoses Caes GatosMariane Domingos SilvestreAinda não há avaliações
- Aloimunização RHDocumento4 páginasAloimunização RHAmanda AlvesAinda não há avaliações
- Mod. II Prob. III FECHAMENTODocumento12 páginasMod. II Prob. III FECHAMENTOgerlan rodriguesAinda não há avaliações
- Nota Técnica - Uso Da Imuniglobulina Anti-Rh (SESA)Documento13 páginasNota Técnica - Uso Da Imuniglobulina Anti-Rh (SESA)Mateus Souza e SivaAinda não há avaliações
- Diagnóstico e tratamento da anemia hemolítica autoimune na criançaDocumento4 páginasDiagnóstico e tratamento da anemia hemolítica autoimune na criançaLarissa OttoniAinda não há avaliações
- Isoimunização RH - MedQDocumento3 páginasIsoimunização RH - MedQBruno MedeirosAinda não há avaliações
- Imunológica e Ao Desenvolvimento Da Doença. O Desequilíbrio Do Sistema Imune Se Caracteriza Pela Presença deDocumento5 páginasImunológica e Ao Desenvolvimento Da Doença. O Desequilíbrio Do Sistema Imune Se Caracteriza Pela Presença deAna Clara LourençoAinda não há avaliações
- Documento Sem Título PDFDocumento2 páginasDocumento Sem Título PDFAlanys MattosAinda não há avaliações
- ImunoDocumento5 páginasImunoDione MendesAinda não há avaliações
- SHF Artigo Relato Caso PediatriaDocumento5 páginasSHF Artigo Relato Caso PediatriaDaniela TudescoAinda não há avaliações
- Texto Do Artigo-73Documento16 páginasTexto Do Artigo-73Diego GuerraAinda não há avaliações
- Doença Hemolítica Do Feto e Recém-NascidoDocumento4 páginasDoença Hemolítica Do Feto e Recém-NascidoMónica SantosAinda não há avaliações
- Aula 3 - Icterícia NeonatalDocumento7 páginasAula 3 - Icterícia NeonatalPhatryck PinheiroAinda não há avaliações
- Protocolo de Reações Infusionais ImediatasDocumento30 páginasProtocolo de Reações Infusionais Imediatasdhankan_raptorAinda não há avaliações
- Patologia Clínica: Trombose, Diabetes e Cálculos RenaisDocumento6 páginasPatologia Clínica: Trombose, Diabetes e Cálculos RenaisGabriele CamposAinda não há avaliações
- Eritroblastose fetal: causas, sintomas e prevençãoDocumento1 páginaEritroblastose fetal: causas, sintomas e prevençãoAna Paula KniphoffAinda não há avaliações
- Autoanticorpos após uso de terapia biológica: estudo multicêntrico brasileiroNo EverandAutoanticorpos após uso de terapia biológica: estudo multicêntrico brasileiroAinda não há avaliações
- Determinação da umidade e efeito da temperatura na formação de gel com amidosDocumento3 páginasDeterminação da umidade e efeito da temperatura na formação de gel com amidosKelly Cristiny Molina SantosAinda não há avaliações
- Coagulopatias: distúrbios da coagulação e coagulogramaDocumento17 páginasCoagulopatias: distúrbios da coagulação e coagulogramaThais Rodrigues de MoraesAinda não há avaliações
- Apresentação1Banner FAMDocumento1 páginaApresentação1Banner FAMThais Rodrigues de MoraesAinda não há avaliações
- Apresentação PI 4 SemestreDocumento1 páginaApresentação PI 4 SemestreThais Rodrigues de MoraesAinda não há avaliações
- SA 8 - ExlabDocumento15 páginasSA 8 - ExlabChristhyanne Dos Santos CarreiroAinda não há avaliações
- Fisiologia Muscular - Faculdade de Medicina Do PortoDocumento53 páginasFisiologia Muscular - Faculdade de Medicina Do Portoluxio100% (2)
- Taxonomia Da DorDocumento38 páginasTaxonomia Da DorrafadxpqAinda não há avaliações
- Sistema reprodutor humanoDocumento11 páginasSistema reprodutor humanoVrohZhell TskAinda não há avaliações
- Ele é conciso e focado no tema principal do documento, que é a estrutura e funções do sistema nervoso centralDocumento32 páginasEle é conciso e focado no tema principal do documento, que é a estrutura e funções do sistema nervoso centralDagmá Rego QueirozAinda não há avaliações
- Corpo Humano Terminologia AnatômicaDocumento44 páginasCorpo Humano Terminologia AnatômicaMarcynha_Ainda não há avaliações
- Teoria Yin Yang na Medicina ChinesaDocumento33 páginasTeoria Yin Yang na Medicina ChinesaSandra Rotondano100% (2)
- Imuno TF - LiteraturaDocumento8 páginasImuno TF - LiteraturaFabiana CostaAinda não há avaliações
- Prova EJA 3ºDocumento1 páginaProva EJA 3ºGeneson BarbosaAinda não há avaliações
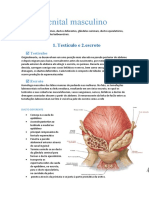
- Resumo Sistema Genital MasculinoDocumento9 páginasResumo Sistema Genital MasculinoLIVIA ANDRADE SANTOSAinda não há avaliações
- ReproduçãoDocumento16 páginasReproduçãoH3ITØRAinda não há avaliações
- Atlas Do Corpo HumanoDocumento18 páginasAtlas Do Corpo HumanoMarlon Carvalho100% (5)
- Oclusão e sistema estomatognáticoDocumento61 páginasOclusão e sistema estomatognáticoJoão Gabriel100% (2)
- Biologia - Volume 01 - Das Células 13 - Tecido ConjuntivoDocumento1 páginaBiologia - Volume 01 - Das Células 13 - Tecido ConjuntivoEcologia Eco100% (1)
- Exercícios Sobre Sist Hormonal Com GabaritoDocumento3 páginasExercícios Sobre Sist Hormonal Com GabaritokakayolimaAinda não há avaliações
- Anatomia da Mama emDocumento3 páginasAnatomia da Mama emLeonardo Florencio0% (1)
- Drenagem Linfática Vodder e LeducDocumento78 páginasDrenagem Linfática Vodder e LeducNarume Amaral80% (5)
- Anatomia do Reto, Canal Anal e PeríneoDocumento37 páginasAnatomia do Reto, Canal Anal e PeríneoPatricia Frizon NobreAinda não há avaliações
- Massagem No Sistema DigestivoDocumento23 páginasMassagem No Sistema DigestivoMaria Teresa Bicca Dode80% (5)
- Laudo - Elizangela Campos CunhaDocumento2 páginasLaudo - Elizangela Campos Cunhad5xszs7fdtAinda não há avaliações
- Centros de força e plexos no corpoDocumento7 páginasCentros de força e plexos no corpoAline GodoyAinda não há avaliações
- Sistema Urináriodocx - 210512 - 094518Documento14 páginasSistema Urináriodocx - 210512 - 094518Anny LaisAinda não há avaliações
- Protocolos AuriculoterapiaDocumento17 páginasProtocolos AuriculoterapiaJamSon LeMos100% (1)
- Instrução Técnica Operacional: Belo Horizonte 2013Documento171 páginasInstrução Técnica Operacional: Belo Horizonte 2013marcosgmaciel100% (1)
- Massagem DO-INDocumento2 páginasMassagem DO-INmicaelrodrigo100% (4)
- Tele Aula 2Documento2 páginasTele Aula 2Tarciomar Castelo BrancoAinda não há avaliações
- Auriculoterapia: mapeamento dos pontos da orelhaDocumento1 páginaAuriculoterapia: mapeamento dos pontos da orelhaSoraia Melo0% (1)
- Fisiologia e fisiopatologia do vómito e da diarreiaDocumento15 páginasFisiologia e fisiopatologia do vómito e da diarreiaJoão SáAinda não há avaliações
- Meridianos e PontosDocumento34 páginasMeridianos e PontosAna SantosAinda não há avaliações
- Terminologia Cirúrgica EssencialDocumento15 páginasTerminologia Cirúrgica EssencialthiagoAinda não há avaliações