Escolar Documentos
Profissional Documentos
Cultura Documentos
Síndrome do Ovário Policístico: Causas, Sintomas e Diagnóstico
Enviado por
Pâmela BuenoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Síndrome do Ovário Policístico: Causas, Sintomas e Diagnóstico
Enviado por
Pâmela BuenoDireitos autorais:
Formatos disponíveis
Síndrome do Ovário Policístico
A síndrome dos ovários policísticos (SOP) é o distúrbio endócrino mais comum nas mulheres em idade reprodutiva, variando de
4 a 16% entre os estudos. Sua primeira descrição data de 1935 quando Stein e Leventhal descreveram o quadro clínico típico
dessa doença. Sua etiologia é multifatorial e ainda não está totalmente esclarecida, envolvendo a predisposição genética e a sua
interação ambiental. Atualmente a SOP é considerada uma doença metabólica, pois além das manifestações ginecológicas, essa
patologia pode cursar com alterações lipídicas, diabetes mellitus (DM), obesidade, hipertensão arterial sistêmica (HAS), aumento
do risco cardiovascular, entre outros fatores. O principal achado clínico nas pacientes com SOP é a associação do
hiperandrogenismo e da anovulação, porém as manifestações clínicas são bastante variadas, incluindo hirsutismo, infertilidade,
acne, obesidade, entre outras manifestações. Sendo assim, para o diagnóstico da SOP é necessário a investigação e exclusão de
outras patologias que cursam com sinais e sintomas semelhantes, como tumores produtores de androgênios, hiperplasia de
adrenal e hiperprolactinemia. Isso é importante visto que terá impacto na instituição da terapêutica adequada, que inclui
regularização dos ciclos menstruais, controle do hiperandrogenismo e distúrbios metabólicos e melhora da qualidade de vida das
pacientes.
Etiologia e Fisiopatologia
A etiologia da SOP ainda é desconhecida, porém acredita-se que sua origem é muitifatorial e envolvem alterações genéticas
poligênicas e suas interações com condições ambientais. Em vários estudos encontra-se uma maior incidência de casos dentro
das famílias, sugerindo a transmissão da alteração genética.
A fisiopatologia da SOP não é muito bem esclarecida, mas sabe-se que ocorre uma alteração da pulsatilidade na liberação do
hormônio GnRH pelo hipotálamo. Entretanto, não se sabe se essa disfunção da pulsação no GnRH é um distúrbio
primário ou secundário a regulação de outros produtos alterados na SOP. De qualquer forma, com a alteração do GnRH,
há um aumento da liberação do LH e uma diminuição da liberação do FSH, ambos produzidos pela hipófise anterior.
GnRH- Hormônio liberador de gonadotrofina, responsável pela liberação de FSH e LH.
LH - Hormônio folículo estimulante, controla a produção de hormônios ovarianos.
FSH - Hormônio luteinizante, controla a produção de hormônios ovarianos.
O papel do LH é de estimular as células da teca a produzirem androgênios. Portanto, se há mais LH, haverá também
maior produção de androgênio, principalmente testosterona e androtenediona. Já o FSH estimula a produção da enzima
aromatase nas células da granulosa. Essas enzimas convertem os androgênios em estrogênios. Sendo assim, como há uma
diminuição da liberação de FSH, ocorre também a redução da produção de estrogênios, propiciando um acúmulo de
androgênios.
TECA - As células da teca são responsáveis pela produção de andrógenos.
GRANULOSA - As células da granulosa são responsáveis pela conversão de androgênios em estrogênios.
O aumento de androgênios ovarianos prejudica o desenvolvimento folicular normal, fazendo com que os folículos fiquem
imaturos e se transformem em múltiplos folículos subdesenvolvidos na periferia ovariana. Além disso, níveis elevados de
androgênios causam alterações no perfil lipídico das pacientes com SOP e também predispõem ao surgimento de acne. Na
periferia, sob ação da enzima 5-alfa-redutase a testosterona é transformada em Di-hidrotestosterona, hormônio que causa
hirsutismo. Os androgênios circulantes são convertidos em estrogênios no tecido periférico, sobretudo nas células do
tecido adiposo, sendo assim, pacientes obesas com SOP tem maior produção de estrogênio.
Devido ao não desenvolvimento folicular, a paciente não ovulará, levando ao quadro de anovulação crônica e por
consequência, oligo ou amenorreia. Como não há ovulação, também não há formação de corpo lúteo, que é o responsável
pela produção de progesterona. Com isso, o endométrio dessa paciente será estimulado somente pelo estrogênio
produzido, sem a oposição da progesterona, levando ao risco de sangramento uterino anormal, hiperplasia endometrial e
câncer de endométrio.
Síndrome do Ovário Policístico 1
Devido ao aumento de androgênios e resistência a insulina presentes em algumas mulheres com SOP, ocorre a diminuição
da produção da Globulina Ligadora de hormônios sexuais (SHBG, de sex hermone-binding globulin) proteína produzida
pelo fígado e responsável pelo carreamento dos esteroides sexuais. Com a redução dessa proteína, ocorre o aumento da
concentração de androgênios livres e disponíveis para se acoplarem aos receptores nos orgãos-alvo. Além disso, alguns
estudos têm demonstrado associação entre baixos níveis de SHBG e DM2 e DM gestacional.
A resistência a insulina e o hiperinsulinismo compensatório podem estar presentes tanto em mulheres magras, quanto em obesas
com SOP. Acredita-se que prevalência de resistência à insulina em mulheres com SOP varia muito de 44% a 70%. A
fisiopatologia envolvida na resistência a insulina ocorre devido a uma anormalidade na sinalização intracelular do
receptor insulínico.
A resistência à insulina é definida como absorção reduzida de glicose em resposta a uma determinada quantidade de
insulina.
A resistência insulínica pode ser responsável por levar a atresia folicular dos ovários, aumento da produção de
androgênios pelos ovários, diminuição da produção de SHBG e na pele leva ao surgimento de acantose nigricans. Além
disso, está associada ao surgimento de DM tipo 2, hipertensão arterial, dislipidemia e doença cardiovascular (DCV).
Cerca de 45% das pacientes com SOP possui síndrome metabólica.
A Síndrome metabólica se caracteriza por resistência à insulina, obesidade, dislipidemia aterogênica e hipertensão
arterial.
Para o diagnóstico da Síndrome Metabólica é necessário a presença de pelo menos três dos critérios abaixo:
1. Circunferência abdominal ≥ 88cm;
2. Triglicérides ≥ 150 mg/dl;
3. HDL < 50 mg/dl;
4. PA≥ 130x85mmHg;
5. Glicemia ≥ 100 mg/dl.
Síndrome do Ovário Policístico 2
Sinais e Sintomas
A SOP se caracteriza por um amplo espectro de manifestações clínicas, dificultando o seu diagnóstico. Em geral, as
apresentações clínicas ficam evidentes anos após a puberdade.
DISFUNÇÃO MENSTRUAL – Em mulheres com SOP as principais disfunções sexuais apresentadas são a
oligomenorreia, amenorreia secundária e/ou sangramento uterino anormal.
Amenorreia/ oligomenorreia: A amenorreia e a oligomenorreia são consequências do estado de anovulação que não
forma corpo lúteo e por isso não produz progesterona. Em algumas pacientes com SOP, a amenorreia pode ser
explicada pelos níveis elevados de androgênios.
Amenorreia secundaria ocorre quando existem ciclos menstruais prévios, porém ocorre ausência de pelo menos 3
ciclos menstruais em mulheres com ciclos regulares ou ausência de menstruação por, pelo menos, seis meses em
mulheres com ciclos irregulares.
Oligomenorreia: ciclos com intervalos maiores que 35 dias entre as menstruações.
Sangramento uterino anormal: Na SOP também podeocorrer sangramentos uterinos que variam de intensidade e
duração e aparecem de maneira imprevisível. Esses sangramentos se devem a estimulação do endométrio pelos
estrogênios, sem contraposição da progesterona, levando a surgimento de um endométrio espesso e instável,
resultando em sangramentos.
HIPERANDROGENISMO – As manifestações do hiperandrogenismo na SOP são principalmente a acne, hirsutismo
e/ou alopecia androgênica.
◊ Acne: A acne se deve ao bloqueio da abertura folicular por hiperceratose, produção excessiva de sebo, proliferação
de Propionibacterium acnes
comensal e inflamação por ação androgênica.
◊ Alopecia: A alopecia ocorre devido a ação da 5-alfa-redutase no folículo piloso, gerando queda do cabelo. A
manifestação mais comum do hiperandrogenismo é o hirsutismo que é definido como a presença de pelos mais
escuros e ásperos em padrão de distribuição tipicamente masculino.
◊ Hirsutismo: Dentro do folículo piloso a testosterona é convertida em di-hidrotestosterona (DTH) pela enzima 5-alfa-
redutase. A testosterona e principalmente a DTH são os responsáveis por engrossar e enegrecer os pelos de áreas
sensíveis a androgênios.
A quantificação da distribuição de pelos pode ser feita utilizando a Escala de Ferriman-Gallwey (Figura 2) que possui
9 imagens com diferentes padrões de hirsutismo, sendo que o seu grau é pontuado de 0 a 4. De acordo com as novas
recomendações da ASRM e ESHRE, a pontuação para considerar o hirsutismo varia de acordo com a etnia da
paciente, sendo considerados ovalor de 4 para orientais ou 6 para outras etnias.
Síndrome do Ovário Policístico 3
A virilização não é uma manifestação comum da SOP. Portanto, em mulheres com sintomas como aumento de massa
muscular, diminuição das mamas, aumento do clítoris e engrossamento da voz, deve-se investigar outras causas de
hiperandrogenismo, principalmente tumorais.
Síndrome do Ovário Policístico 4
Medicamentos como esteroides anabolizantes, metoclopramida, metildopa, testosterona e progestágenos podem gerar
hirsutismo em mulheres. Por isso, devemos estar atentos ao uso dessas substâncias quando estivermos diante de um quadro de
hirsutismo.
DISFUNÇÕES ENDÓCRINAS
Mesmo em pacientes com índice de massa corporal (IMC) ideal, é comum na SOP a ocorrência de resistência
insulínica, intolerância a glicose e DM2.
◊ Resistência insulínica: Um dos marcadores da resistência insulínica é o aparecimento de acantose nigricans que é
a consequência do estímulo insulínico no desenvolvimento de queratinocitos e fibroblastos da pele, levando ao
espessamento e escurecimento em áreas de flexão da pele, principalmente nas axilas e na nuca.
◊ DM2/intolerância a glicose: mulheres com SOP apresentam risco elevado de desenvolver DM tipo 2 e
intolerância a glicose devido a disfunção das células beta pancreáticas presente nessa patologia.
DISLIPIDEMIA
A dislipidemia tem alta prevalência na SOP e se caracteriza por níveis elevados de lipoproteína de baixa densidade
(LDL), triglicerídeos e colesterol, além níveis reduzidos de lipoproteína de alta densidade (HDL).
Sendo assim, a Síndrome Metabólica é uma entidade frequente nas mulheres com SOP.
OBESIDADE
Cerca de metade das pacientes com SOP são obesas, ou seja, tem IMC maior que 30. O padrão típico é andrógeno,
com aumento da relação cintura/quadril. Esse aspecto contribui para o desenvolvimento de dislipidemia e aumento o
risco cardiovascular presentes em mulheres com SOP.
APNEIA OBSTRUTIVA DO SONO
Tem alta prevalência em mulheres com SOP e está relacionada com obesidade central, resistência insulínica e
alterações metabólicas e hormonais presentes na SOP.
NEOPLASIA ENDOMETRIAL
Mulheres com SOP tem três vezes mais chance de desenvolver neoplasias endometriais devido ao quadro de
anovulação crônica, associada a estimulação estrogênica sem oposição progestágena.
INFERTILIDADE
Como descrito acima, devido ao processo de alteração do eixo hipotálamo-hipófise-ovariano, ocorre anovulação, visto
que o desenvolvimento folicular não é completado. Dessa forma, a SOP é responsável por cerca de 80% dos casos de
infertilidade anovulatória.
HIPERTENSÃO ARTERIAL
A hipertensão arterial tem risco aumentado de ocorrer em pacientes com SOP. Ela ocorre sobretudo no final da idade
reprodutiva.
Diagnóstico
Existem vários critérios que podem ser usados para o diagnóstico da síndrome dos ovários policísticos, como o National
Institutes of Health (NIH), Consenso de Rotterdam e Androgen Excess and PCOS Society (AEPCOS). O mais utilizado é o
critério de Rotterdam que leva em conta um consenso entre a European Society for Human Reproductive Medicine (ESHRE) e
a American Society for Reproductive Medicine (ASRM)(Quadro 1). Segundo esse consenso está presente pelo menos dois dos
três critérios propostos para o diagnóstico: oligo-amenorreia, hiperandrogenismo clínico e/ou laboratorial e morfologia
ultrassonográfica de policistose ovariana. Além disso, é obrigatório que outras doenças que causam hiperandrogenismo
deve ser excluídas.
Síndrome do Ovário Policístico 5
De acordo com os critérios de Rotterdam é possível o diagnóstico de SOP em mulheres com ciclos regulares e ovulatórios,
desde que tenha hirsutismo e ovários policísticos a USG, item obrigatório nos outros critérios citados acima. Outro ponto
é de que com esses critérios, é possível haver pacientes com SOP sem os sinais de hiperandrogenismo, que caracteriza a
doença.
De acordo com esses critérios, entende-se por alteração no ciclo menstrual a ausência de menstruação por um período de
90 dias ou mais ou a presença de um número de ciclos menstruais menor ou igual a 9 por ano. Em relação ao
hiperandrogenismo, deve-se pontuar esse critério quando houver pelo menos um dos seguintes achados: Acne, hirsutismo
e alopecia de padrão androgênico ou hiperandrogenismo laboratorial.
O hiperandrogenismo laboratorial ocorre quando há elevação de pelo menos um androgênio, que pode ser testosterona
total, androstenediona e/ou sulfato de desidroepiandrosterona sérica (SDHEA).
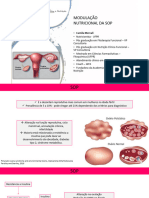
Com relação a presença de ovários policísticos à USG, deve ter mais de 20 folículos antrais de tamanho entre 2 e 9 mm,
em pelo menos um dos ovários ou volume ovariano de maior ou igual à 10 cm3 (Imagem 3). Não deve ser considerado o
ovário que apresente folículo dominante ou corpo lúteo. Nesses casos, o exame deve ser repetido.
Novos estudos tem usado o hormônio anti-mulleriano (HAM) como método diagnóstico, com evidências de boa correlação
entre os os seus níveis e a contagem de folículos, volume ovariano e distribuição periférica dos folículos. Com base nesses
Síndrome do Ovário Policístico 6
estudos, o HAM está sendo contado para substituir a USG, no entanto, devido a discrepâncias no ponto de corte entre
esses estudos, o HAM ainda não é utilizado como critério diagnóstico.
Em exames complementares temos:
LH e FSH: Normalmente virá com a relação aumentada, maior que 2
BHCG: para exclusão de gravidez em pacientes com amnorreia.
Avaliação hormonal: Testosterona, androstenediona e SDHEA, que podem estar normais ou levemente aumentados.
SGBG que estará reduzida devido a redução da sua síntese no fígado por ação dos andrógenos circulantes
Para o diagnóstico de SOP outras causas de hiperandrogenismo devem ser excluídas. Por isso, é recomendado a
investigação dos principais diagnósticos diferenciais
Diagnósticos diferenciais de Hiperandrogenismo Investigação
Disfunções tireoidianas Dosagem de hormônio tireoestimulante (TSH) e/ou T4 livre
Hiperprolactinemia Dosagem de prolactina
Tumor ovariano produtor de androgênio Dosagem de testosterona total ou livre e ultrasson de ovário
Tumor adrenal Dosagem de deidopiandrosterona sulfatada (DHEA-S)
Hiperplasia adrenal congênita Dosagem de 17-alfa-hidroxiprogesterona (17OHP)
Insuficiência ovariana primária Dosagem de hormônio folículo estimulante (FSH)
Como já descrito, disfunções metabólicos como a resistência insulínica, obesidade e o risco de diabetes tipo 2, estão
presentes na SOP. Por isso, é importante a investigação dessas patologias, seja no exame físico através da circunferencial
abdominal, pressão arterial e da investigação metabólica e bioquímica, com a avaliação do metabolismo glicídico (Glicemia de
jejum e/ou TTGO) e lipídico (colesterol total e frações e triglicérides). Essa investigação servirá também para o diagnóstico da
Síndrome Metabólica, entidade frequente nas pacientes com SOP.
Em adolescentes, os critérios diagnósticos para SOP são controversos, visto que nesse período da vida os sinais e sintomas
sugestivos da SOP podem ser confundidos com os que ocorrem na puberdade normal. De um modo geral, novos consensos
recomendam que para o diagnóstico de SOP, as adolescentes devem estar presentes os três critérios citados no consenso de
Rotterdam e não dois, como nos adultos. No entanto, para essa faixa etária a morfologia ovariana não é considerada, e o
hiperandrogenismo implica necessariamente na presença de hirsutismo ou hiperandrogenemia. Além disso, mesmo que
preencha esses critérios, é recomendado que o diagnóstico feito na adolescência deve ser revisto após oito anos da
menarca ou até postergado para depois dos 18 anos completos. Neste caso, deve-se tratar os sintomas como distúrbio
menstrual e hirsutismo, independentemente do diagnóstico definitivo de SOP.
Tratamento
A SOP possui uma ampla gama de sinais e sintomas com grande impacto na qualidade de vida das pacientes. Por isso o
tratamento dos sintomas da SOP varia de acordo com as queixas de cada paciente individualmente. Além disso, o tratamento
precoce da SOP reduz a morbimortalidade por doenças cardiovasculares.
NÃO MEDICAMENTOSO
Uma das queixas frequentes entre as pacientes com SOP é o sobrepeso e obesidade e para isso, como na população geral
recomenda-se modificações do estilo de vida, com cessação do tabagismo e do uso abusivo de álcool, prática de atividade
física regular e alimentação saudável. A perda de peso está associada a melhora da obesidade, dislipidemia, hipertensão,
doença hepática gordurosa não alcoólica, apneia do sono, regulação endócrina, hiperglicemia e efeitos positivos na
normalização dos ciclos menstruais. Evidências apontam que a perda de peso melhora os índices de ovulação, contribuindo
para redução da infertilidade. Além disso, está relacionada a redução de abortamentos e doenças gestacionais, tanto fetais,
quanto maternas.
Síndrome do Ovário Policístico 7
Para o hirsutismo, medidas cosméticas como métodos de depilação e epilação (retirada inteira dos pelos) também podem ser
empregados.
A depilação é a técnica mais utilizada, no entanto, efeitos colaterais como irritação da pele podem surgir. Dentre as técnicas de
epilação pode-se usar a retirada mecânica dos pelos com pinça, cera e laser
ou através da retirada permanente com a destruição térmica dos folículos pilosos.
É comum em pacientes com SOP problemas psicológicos, como ansiedade e depressão, devido ao impacto do hiperandrogenismo
na feminilidade e autoestima, sendo necessário uma abordagem multidisciplinar com profissionais ligados a saúde mental.
MEDICAMENTOSO
O tratamento medicamentoso visa reduzir as queixas mais comuns das pacientes com SOP.
◊ Irregularidade menstrual: Para o tratamento da irregularidade menstrual, é recomendado o uso preferencial
deanticoncepcionais hormonais combinados (AHC) no tratamento de mulheres com SOP que não desejam gestar. Esses
medicamentos além de promover a regularização dos ciclos menstruais e anticoncepção, também estão ligados a redução dos
níveis de androgênios circulantes e promove antagonismo endometrial com a progesterona. Isso ocorre pois o estrogênio dos
AHC aumenta a síntese e liberação de SHBG no fígado, reduzindo a quantidade de testosterona livre. Dessa forma, os AHC
diminuem o hirsutismo e mais da metade das pacientes e reduz a proliferação endometrial. Mulheres que possuem
contraindicação ao uso de AHC, podem fazer uso de progestágenos isolados para
regularização do ciclo, porém esse medicamento não previne a gravidez e o não melhora o hirsutismo, além de está ligado a
efeitos colaterais como cefaleia e ganho de peso.
Em mulheres com amenorreia, deve-se descartar gestação antes de iniciar o uso dos anticoncepcionais. Alguns estudos
apontam que com o uso da metformina, além da melhora no perfil metabólico, está associada a redução da secreção de
androgênios, melhorando assim o ciclo menstrual. Com isso, esse medicamento pode ser usado no tratamento de segunda
linha para melhora das irregularidades menstruais em mulheres com SOP.
◊ Hiperandrogenismo clínico: Para o tratamento do hirsutismo clínico assim como de graus moderado e grave e da acne,
pode-se utilizar os antiandrogênicos, associado a AHC. A medicação de escolha é o acetato de ciproterona. Entretanto, esses
medicamentos estão associados ao ganho de peso e redução da libido.
Os antiandrogênicos estão ligados a feminilização de fetos masculinos, por isso sempre deve está associado a métodos
contraceptivos. Ademais, os AHC além de promover a regularidade menstrual, estão ligados a redução dos androgênios
livres, reduzindo o hirsutismo. Medicações antiandrogênicas como espironolactona e finasterida que é um inibidor da enzima
5-alfa-redutase também podem ser utilizadas no tratamento do hirsutismo, mas possuem alguns efeitos colaterais, sendo mais
usadas quando há contraindicação ou não resposta às demais medicações.
◊ Distúrbios metabólicos: Para mulheres que não atingiram controle metabólico com a melhora da qualidade de vida, a
metformina pode ser recomendada como adjuvante. Essa medicação é associada à redução da resistência insulínica,
obesidade e melhora do perfil lipídico, além de reduzir a gliconeogênese hepática e melhorar as taxas de ovulação.
◊ Infertilidade: Pacientes que desejam gestar pode utilizar medicações que induzem a ovulação, sendo a droga deprimeira
escolha o Citrato de Clomifeno. Essa medicação possui bons níveis de ovula-
ção e gravidez. Na intolerância a essa droga, pode-se utilizar ainda gonadotrofinas. Vale lembrar que com o uso dessas
medicações a paciente deve ser monitorada com ultrassonografias visando melhor eficacia gestacional e identificação de
efeitos colaterais como a Síndrome do hiperestímulo ovariano. A fertilização in vitro FIV) também tem altas taxas de sucesso
em pacientes com SOP que desejam engravidar. Cirurgias para ressecção da cunha ovariana e eletrocauterização ovariana
(Drilliing ovariano) também podem ser empregadas em casos elecionados.
◊ Cirurgia bariátrica: Pacientes com SOP que tenham dificuldade de perda de peso, sobretudo com obesidade grave, podem
utilizar a cirurgia bariátrica como opção de tratamento. Essa cirurgia, independente da técnica empregada, está relacionada à
redução ponderal, regularização hormonal e metabólicos, além de melhoria no hirsutismo, irregularidade menstrual e
fertilidade.
Síndrome do Ovário Policístico 8
Climatério
Segundo a OMS, o climatério corresponde ao período de transição da vida da mulher compreendido entre a fase final da fase
reprodutiva e a senilidade, iniciando-se, geralmente, entre a metade e o fim da quarta década, e durando aproximadamente 4 anos.
É uma fase marcada por modificações endócrinas, físicas e psicológicas; que podem ser amenizadas por medidas preventivas que
melhoram a qualidade de vida das pacientes.
Durante esse período, ocorrem alterações do padrão menstrual tipico da mulher (duração do ciclo e do fluxo, intensidade do
fluxo), até que ocorre a menopausa, definida como a interrupção permanente da menstruação, sendo reconhecida após 12 meses
consecutivos de amenorreia.
A menopausa ocorre, em média, aos 51 anos, variando entre 45 e 57 anos. Durante a fase reprodutiva (pré-menopausa), há
ovulação regular e sangramento menstural cíclico, enquanto a pós-menopausa é caracterizada pela amenorreia e infertilidade.
Etiopatogenia
A etiopatogenia desse período envolve todo o eixo hipotalamo-hipófise-ovário, mas a maior importância é concentrada nas
alterações dos folículos ovarianos.
A partir do quinto mês de desenvolvimento fetal inicia-se a atresia (involução) folicular, que continua até a menopausa. Durante o
climatério, há o desaparecimento completo dos folículos e das células germinativas, marcando a esterilidade definitiva, com
diminuição progressiva de estrógeno e da inibina. Por outro lado, por mecanismo de feedback aumentam-se FSH e LH na
tentativa de manter a foliculogênese. Esses altos níveis de gonadotrofinas levam à atrofia estromal e maior produção de
androgênios, que serão convertidos em estrona — principal hormônio da mulher no climatério.
Além disso, o envelhecimento do eixo hipotálamo-hipófise acarreta alterações no metabolismo dopaminérgico e diminuição dos
receptores androgênicos.
Essas modificações de apresentam como insuficiência do corpo lúteo, determinando irregularidades menstruais e evoluindo mais
tardiamente para amenorreia, por anovulação temporária ou definitiva.
Manifestações clínicas
Nos últimos anos reprodutivos, antes do inicio da transição da menopausa, os ciclos menstruais são ovulatórios, mas fase
folicular (a primeira metade do ciclo menstrual, antes da ovulação ocorrer) começa a encurtar, gerando dificuldade para
engravidar, o que faz com que muitas mulheres procurem atendimento nesse período. Além disso, os ciclos se alargam, passando
a durar cerca de 40-50 dias; mais tardiamente, os ciclos se tornam intercalados, com episódios de amenorreia e uma frequência
crescente de ciclos anovulatórios. E, após anos de irregularidade menstrual, ocorre a cessação permanente — menopausa.
Além disso, vários sintomas marcam o climatério, sendo o mais reconhecido deles o fogacho, que é caracterizado por ondas de
calor que ocorrem várias vezes ao dia, iniciando na parte superior do tórax, pescoço e cabeça, podendo se tornar generalizada,
durando de dois a quatro minutos. Por ser mais frequente a noite, a dificuldade para dormir também é uma queixa frequente
dessas pacientes. Porém, os distúrbios do sono fazem parte da síndrome da menopausa, e nem sempre está relacionada aos
fogachos.
Os sintomas vasomotores, que incluem fogachos, sudorese e calafrios, nada mais são do que um fenômeno de termorregulação.
Um fogacho é como uma resposta de dissipação de calor, porque ambos resultam em vasodilatação, sudorese e redução na
temperatura corporal central. Porém, as mulheres que se encontram na menopausa têm redução da faixa de temperatura nula (em
que não se faz necessária a termorregulação), fazendo com que variações normais na temperatura corporal resultem em fogachos.
Síndrome do Ovário Policístico 9
Além disso, cita-se também sintomas de depressão, alterações cognitivas, dores articulares, disfunção sexual (dispareunia,
redução de libido), disúria, urgência urinária e secura vaginal.
A atrofia e diminuição da lubrificação vaginal, causadas pela deficiência de estrogênio circulante, cursam com dispareunia e
queda de libido, culminando no déficit da qualidade de vida e satisfação sexual das mulheres.
Em longo prazo, a queda de estrogênio leva a osteoporose (diminuição da atividade dos osteoblastos e elevação da atividade dos
osteoclastos), mudança do perfil lipídico (elevação dos níveis de LDL), alterações da pele (queda de colágeno, que leva ao
enrrugamento), alterações no equilíbrio (explicando a alta incidência de fraturas em antebraço nesse público) e manifestações
urogenitais (atrofia de epitélio e tecidos pélvicos de sustentação, tornando a mucosa mais delgada e propiciando prolapso
genitais) como aumento da frequência e urgência miccional.
Ademais, a mulher fica mais suscetível a cistites (infecções urinárias baixas), uma vez que o déficit de estrogênio faz com que o
epitélio da vagina perca a capacidade de produzir a lubrificação natural e de acidificar as secreções. Assim, com o pH mais
elevado que o normal, a vagina se torna um sítio oportuno para a povoação por E. coli, que com recorrência pode migrar para a
uretra e causar a infecção do trato urinário, manifestada pela disúria.
Diagnóstico
O diagnóstico de climatério é, na grande maioria das vezes, clínico e baseado nas queixas das pacientes e possíveis achados de
exame físico, como: atrofia urogenital, adelgaçamento da mucosa vaginal como coloração rosa-pálida, perda de rugosidade, com
diminuição da distensibilidade e encurtamento da vagina. Nãe se faz uso rotineiro das dosagens de gonadotrofinas, esteroides
sexuais e da colpocitologia hormonal.
Os exames realizados nesse período são para rastreamento e identificação de doenças crônicas, como doenças cardiovasculares e
síndromes metabólicas (solicitação de perfil lipídico e glicemia), osteoporose (densitometria óssea) e hipotireoidismo (dosagem
Síndrome do Ovário Policístico 10
de TSH e T4 livre).
Além disso, dado que a maioria das modalidades de câncer tem sua incidência aumentada com a idade, é necessário fazer
rastreamento nessas pacientes.
O câncer de mama é o que mais preocupa as mulheres, assim é recomendado além do autoexame, exame clínico manual e
mamografia para todas. No Brasil, o Ministério da Saúde indique que a mamografia seja realizada a partir dos 50 anos. Nas
mulheres em que há alto risco hereditário, a recomendação é realizar a primeira mamografia aos 40 anos ou 10 anos antes da
idade em que o parente de primeiro grau teve a neoplasia, o que vier primeiro.
O rastreio dos outros locais do aparelho reprodutor que podem desenvolver tumores malignos — vulva, vagina, cérvix,
endométrio e ovários — é feito pelo USG transvaginal.
Tratamento
Para tratamento dos sintomas climatéricos tem-se disponíveis as terapias de reposição hormonal (TH) e não hormonais. É dever
do médico oferecer as opções mostrando as vantagens e desvantagens de cada alternativa existente.
Terapia não hormonal
Constitui um conjunto de medidas (medicamentos ou não) utilizadas para aquelas pacientes que não querem ou não podem
realizar a terapia hormonal (pacientes com câncer de mama ou endométrio, doença tromboembólica, hepatopatias e
sangramento genital de causa não esclarecida, por exemplo).
Das orientações não medicamentosas para alívio dos sintomas do climatério, destaca-se a importância da realização de
atividades físicas e boa alimentação. Essa combinação tem importante papel na prevenção e tratamento de vários problemas
associados à menopausa e envelhecimento, tais como doenças cardiovasculares, câncer, obesidade, fraqueza muscular,
osteoporose e depressão. A cessação do tabagismo também deve ser recomendada. A escolha por terapias alternativas, como
uso de fito-hormônios e homeopatia, também é uma opção a ser considerada a depender da vontade da paciente.
O uso de hipotensores e vasoconstritores, como clonidina e metildopa (agonistas adrenérgicos), propanolol (beta
bloqueador), cinarizina (anti-histamínico com efeito vasoconstritor), é válido para tratamento dos sintomas vasomotores,
mesmo que o resultado não seja tão eficaz quanto ao da terapia hormonal.
Ansiolíticos e antidepressivos (paroxetina) também podem ser aplicados para controle de sintomas psicológicos desse
período.
Terapia hormonal
É mais eficaz para o alívio dos sintomas do climatério, principalmente os sintomas vasomotores. Porém seu uso em longo
prazo para prevenção de doenças não é mais recomendado.
O uso apenas de estrógeno é recomendado para mulheres histerectomizadas, ao passo que para as que têm útero íntegro,
deve ser feita a terapia combinada — estrógeno e progesterona — uma vez que o uso isolado de estrógeno pode levar a
hiperplasia e ao câncer endometrial.
Por outro lado, a combinação com progesterona, segundo alguns estudos, parece aumentar o risco de eventos
coronarianos, embolia pulmonar, câncer de mama e demência.
Pacientes que cursam apenas com atrofia vaginal e sem nenhum outro sintoma, podem fazer uso de estrógeno tópico
(vaginal), que gera mínima absorção sistêmica.
O uso de terapia hormonal é prescrito para tratamento de doenças crônicas e prevenção de demência ou melhora de
sintomas cognitivos. Há estudos comprovando que os estrógenos são fatores protetores apenas de fraturas, e não de
eventos coronarianos e demência como se teorizava antigamente. Mesmo sendo fator protetor para fraturas, o seu uso
não se justifica, uma vez que o uso de bisfosfonados é mais adequado, devido à efetividade e à maior segurança.
Síndrome do Ovário Policístico 11
Não é recomendado para mulheres na pós-menopausa ou maiores de 60 anos. O início da terapia hormonal deve ser feito
entre o final da quarta década e o final da quinta. De forma quecom a redução dos sintomas vasomotores, deve-se fazer
redução gradual da terapia hormonal até interrompê-la completamente.
O guideline da Sociedade de Endocrinologia recomenda calcular o risco cardiovascular e de câncer de mama antes do
início da terapia hormonal.
Uma vez optada pela terapia hormonal, deve-se considerar o tipo de estrogênio, a via de administração e a necessidade de
progestínico.
Para mulheres com moderado risco cardiovascular e risco de tromboembolismo venoso, é indicado uso de estrogênio
transdérmico, já para as demais a preparação oral de 17-beta estradiol é muito utilizada. A eficácia de todas as vias é
semelhante.
Quando a dose, é indicado iniciar com doses menores de estrogênio (estradiol 17-beta oral 0,5mg/dia ou 0,025 mg de
estradiol transdérmico), a menos que a paciente tenha sintomas graves. Já para a progesterona 200mg/dia por 12 dias no mês
ou 100 mg/dia ininterruptos. (75mg)
O uso de anticoncepcionais orais de 20 mg de etinilestradiol pode ser feito para mulheres que buscam alivio dos sintomas da
menopausa e que também desejam ter certeza de contracepção e controle do sangramento.
Estudos comprovam que já no primeiro ano mais de 50% das mulheres já apresentam melhoras dos sintomas e já estão
prontas para finalizar o tratamento que é indicado ser feito de forma gradual. A duração da terapia deve ser de mais ou
menos até cinco anos. Se após a cessação do uso de hormônios, os sintomas continuares, deve-se optar por terapias não
hormonais antes do reinicio da terapia hormonal.
Infertilidade
Conceitua-se infertilidade conjugal quando não ocorre gravidez em casal que mantenha relações sexuais frequentes sem proteção
contraceptiva, pelo período de um ano (12 meses). Portanto, normalmente a investigação do casal infértil inicia-se após pelo
menos um ano de exposição sexual sem gravidez. A investigação antes de um ano se justifica em mulheres com mais de 35 anos,
ciclos menstruais irregulares, história de doença inflamatória pélvica (DIP), diagnóstico ou suspeita de endometriose, cirurgias
abdominais anteriores e problemas masculinos conhecidos.
Epidemiologia
A infertilidade pode ser dividida em primária, ou seja, não há gravidez anterior, e secundária, aquela na qual ocorreu pelo menos
uma concepção anterior. Já fecundidade é a capacidade de conceber. A probabilidade mensal de concepção se situa entre 20 e
25%. Entre aquelas mulheres que estejam tentando conceber, cerca de 50% estarão grávidas em três meses, 75% em seis meses e
85% em um ano. Nos últimos 40 anos, a prevalência da infertilidade permaneceu estável. Porém, a busca por investigações e
tratamento aumentou consideravelmente. Isso ocorreu devido aos avanços no tratamento da infertilidade, que hoje são
amplamente divulgados e faz com que as pacientes tenham maior expectativa de que a intervenção médica as ajude a atingir seus
objetivos. A infertilidade é uma condição comum que afeta entre 10 e 15% dos casais em idade reprodutiva. Apesar disso, 50%
desses casais irão conceber no segundo ano de tentativa mesmo sem tratamento.
Etiologias
Fator ovulatório
As principais causas que interferem no fator ovariano são: a Síndrome dos Ovários Policísticos (SOP), as tireoidopatias e a
hiperprolactinemia. Cerca de 80 a 90% dos casos estão relacionados à SOP. O percentual restante corresponde a pacientes
com hipotireoidismo manifesto ou subclínico, geralmente, e quadros de mulheres com desordem endócrina causada pelo
aumento da secreção de prolactina pela hipófise, podendo resultar em galactorréia, irregularidades menstruais e infertilidade.
Diante dessas situações os principais métodos de investigação diagnóstica são:
Síndrome do Ovário Policístico 12
PADRÃO MENSTRUAL: o histórico menstrual da paciente é um excelente preditor de ovulação regular. Mulheres com
menstruação cíclica em intervalos de 25 a 35 dias e duração de sangramento de 3 a 7 dias muito provavelmente tenham
ovulação normal.
PROGESTERONA SÉRICA: é possível testar a ovulação por meio da dosagem sérica na fase mesolútea. Em um ciclo
clássico de 28 dias, o soro deve ser obtido no 21o dia, contando a partir do primeiro dia de sangramento menstrual, ou 7
dias após a ovulação. Valores acima de 4 a 6 ng/ml estão fortemente relacionados com ovulação e com produção de
progesterona elo corpo lúteo (obs.: acima de 3 ng/ml segundo a FEBRASGO). Devido a progesterona ser secretada em
pulsos, dosagens em várias amostras são necessárias para determinar a presença de ovulação ou não.
BIÓPSIA ENDOMENTRIAL: avalia a mudança histológica provocada pela progesterona, levando o endométrio ao
padrão secretor que confirma a ovulação. Esse método é bastante dispendioso e invasivo por isso não é realizado de
rotina.
ULTRASSONOGRAFIA (USG): as USGs ovarianas seriadas mostram o desenvolvimento de folículos antrais maduros
e seu subsequente colapso durante a ovulação. É uma excelente
abordagem para corroborar o diagnóstico de SOP.
Avaliação da reserva ovariana
a) Hormônio antimulleriano (AMH)
O AMH é expresso pelas células da granulosa de folículos com 6mm. Portanto, este hormônio estima a quantidade de
folículos primordiais. Os valores de AMH permanecem inalterados
durante todo o ciclo menstrual e entre diferentes ciclos, o que facilita sua realização O valor considerado normal é
1ng/ml. Níveis abaixo desse valor se relacionam com baixa resposta ovariana
em ciclos de fertilização in vitro e embriões de má qualidade.
b) Dosagem de FSH
A dosagem de FSH no 3o dia do ciclo é um método simples e de menor custo. Valores abaixo de 10mUI/ml refletem boa
reserva ovariana, níveis entre 10 e 15 são considerados
borderline. Taxas elevadas de estradiol podem estar relacionadas à elevação inicial do FSH em mulheres com baixa
reserva ovariana. Altos níveis de estradiol podem inibir a produção hipofisária
de FSH, mascarando um dos sinais de reserva ovariana diminuída em mulheres perimenopausa. Assim, é importante
utilizar a dosagem concomitante de FSH e estradiol para evitar testes falsos
negativos de FSH.
c) Contagem de folículos antrais (CFA)
É realizada no início da fase folicular, entre o 3o, 4a ou 5o dia do ciclo, por meio da ultrassonografia transvaginal (USG-
TV). Mulheres com CFA ≥ 10 folículos medindo de 2 a 10 mm
correlacionam-se com boa reserva ovariana em ciclos de reprodução assistida.
A avaliação da função tireoidiana por meio da dosagem de TSH e T4 LIVRE e a dosagem de PROLACTINA
também são importantes para a análise do Fator Ovulatório.
Fator tuboperitoneal
Estima-se que o fator tubário seja responsável por 35 a 40% dos casos de infertilidade feminina. Sintomas como dor pélvica
crônica ou dismenorreia sugerem obstrução tubária, aderências pélvicas ou ambas. As aderências impedem o movimento
normal da tuba, a captura do óvulo e o transporte de óvulos fertilizados para o útero. Dentre as principais etiologias que
contribuem para as doenças tubárias destacam-se a doença inflamatória pélvica (DIP), a endometriose e cirurgia pélvica
anterior, além de tuberculose genital (3 a 5% dos casos). A avaliação da permeabilidade tubária pode ser feita com
histerossalpingografia (HSG) ou com cromotubagem laparoscópica.
Síndrome do Ovário Policístico 13
HSG: é o teste padrão para doenças tubárias. Para sua realização, instila-se contraste iodado por meio de cateter instalado no
útero. Sob fluoroscopia, o corante é acompanhado enquanto preenche a cavidade uterina, o lúmen tubário e finalmente
transborda pelas fímbrias para a cavidade pélvica (figura 1). Esse extravasamento de contraste para a cavidade abdominal,
bilateralmente, é denominado prova de Cotte positiva e evidencia permeabilidade tubária. A HSG não deve ser feita em
casos de concepção, sangramentos graves e infecções.
CROMOTUBAGEM VIA LAPAROSCOPIA: é realizada através de introdução de azul de metileno pelo canal endocervical
para avaliar se há patência tubária.
Fator uterino
As anormalidades uterinas podem ser a causa de um quadro de infertilidade. Essas podem ser hereditárias ou adquiridas. As
anomalias hereditárias mais comuns são septo uterino (figura 2),
útero bicorno, útero unicorno e útero didelfo (figura 5). Já as anormalidades adquiridas consistem em pólipos intrauterinos,
leiomiomas e Síndrome de Asherman. Os pólipos são tumores carnudos
e de consistência mole e estão presentes em cerca de 3 a 5% das mulheres inférteis. Já os leiomiomas são tumores
musculares lisos benignos, que podem impedir a implantação do zigoto no útero a depender do seu tamanho e localização.
Os leiomiomas podem obstruir as tubas uterinas, deformar ou preencher a cavidade uterina, prejudicando a implantação. Por
fim, a Síndrome de Asherman consiste em um quadro de aderências intrauterinas, também conhecidas como sinéquias
(figura 3). Ocorre com maior frequência em mulheres com antecedente de dilatação e curetagem uterina, particularmente no
contexto de infecção e gravidez.
Síndrome do Ovário Policístico 14
A avaliação endoscópica da cavidade intrauterina é o principal método para definir anormalidades no interior do útero.
Portanto, a HISTEROSCOPIA se destaca como padrão-ouro nesse sentido. Esse procedimento pode ser realizado em
ambiente ambulatorial ou em centro cirúrgico e além da capacidade de diagnosticar também pode servir como instrumento
terapêutico (figura 4).
Outras opções para a investigação do fator uterino são a Histerossalpingografia (HSG) e a Histerossonografia. Essa última é
caracterizada por infusão de contraste específico ou soro
fisiológico na cavidade uterina durante a realização de uma USG-TV.
Síndrome do Ovário Policístico 15
Fator masculino
Em geral as causas de infertilidade masculina podem ser classificadas como anormalidades na produção de espermatozoides,
anormalidades espermáticas funcionais e obstrução dos ductos deferentes. A avaliação inclui frequência de coito, duração da
infertilidade, doenças na infância e informações sobre o desenvolvimento, presença de doenças sistêmicas, cirurgias prévias,
medicações e história sexual, incluindo infecções sexualmente transmissíveis (ISTs). Fertilidade prévia não exclui a necessidade
de investigar o fator masculino.
O Espermograma é o principal exame na avaliação da fertilidade masculina. Para sua realização, solicita-se ao paciente que se
mantenha sem ejacular por 2 a 3 dias. Logo após esse período coleta-se uma amostra de seminal em frasco esterilizado por meio
de masturbação. Se a masturbação não for uma opção, o casal pode usar um preservativo especialmente produzido sem
lubrificante. Para que a análise seja ideal, é importante que a amostra seja entregue no laboratório no prazo de 1 hora desde a
ejaculação. Os valores de referência para análises do sêmen são:
Síndrome do Ovário Policístico 16
Algumas anormalidades no espermograma podem ser identificadas:
ASTENOZOOSPERMIA: diminuição na motilidade dos espermatozoides.
AZOOSPERMIA: ausência de espermatozoides na amostra ejaculada.
OLIGOZOOSPERMIA: diminuição da concentração de espermatozoides.
TERATOZOOSPERMIA: morfologia anormal dos espermatozoides.
Tratamento
Técnicas de baixa complexidade
INSEMINAÇÃO INTRAUTERINA (figura 6): nessa técnica, utiliza-se um cateter flexível para depositar amostra de sêmen
preparado no interior da cavidade uterina. Primeiro, separam-se
espermatozoides móveis e morfologicamente normais de espermatozoides mortos, leucócitos e plasma seminal. A fração de
espermatozoides de alta mobilidade é inserida através do colo uterino
próximo da data prevista para a ovulação. Essa terapia é a mais adequada para o tratamento de fatores masculinos leves e
moderados.
Síndrome do Ovário Policístico 17
Coito programado
consiste em programar o coito no período da janela fértil. É importante que o casal apresente tubas e sêmen normais.
Tanto para inseminação intrauterina como para o coito programado pode-se associar a indução da ovulação. Essa última é
realizada com medicações que estimulam o desenvolvimento folicular e a ovulação. O citrato de clomifeno é a droga mais
empregada nesse sentido. Ela possui propriedades agonista e antagonista estrogênicas. As propriedades antagonistas
predominam, exceto quando os níveis de hormônios estão extremamente baixos. Como resultado, há redução do feedback
negativo normal do estrogênio no hipotálamo. Esse, portanto, secreta o hormônio liberador de gonadotrofina (GnRH), que, por
sua vez, estimula a hipófise a liberar gonadotrofinas, resultando, assim, no aumento do FSH, que estimula a atividade folicular
ovariana.
Técnicas de alta complexidade
Fertilização in vitro
Durante a FIV (figura 7), oócitos maduros provenientes de ovários estimulados são recuperados por via transvaginal
com direcionamento ultrassonográfico. Os espermatozoides e os
óvulos são combinados in vitro para que haja fertilização. Se bem-sucedido, os embriões são transferidos por via
transcervical até a cavidade endometrial sob direcionamento ultrassonográfico.
Doença tubária grave, doenças genéticas, resultado ruim do espermograma e falha com outras técnicas são as principais
indicações de FIV.
Síndrome do Ovário Policístico 18
Clomifeno
Síndrome do Ovário Policístico 19
Você também pode gostar
- A Infertilidade Não É Apenas Um Problema Do CasalNo EverandA Infertilidade Não É Apenas Um Problema Do CasalNota: 2 de 5 estrelas2/5 (1)
- #005 Conduta Nutricional Na Sindrome Do Ovário Policístico (SOP)Documento62 páginas#005 Conduta Nutricional Na Sindrome Do Ovário Policístico (SOP)Regiane Reis100% (1)
- SOP: Manifestações da Síndrome do Ovário PolicísticoDocumento10 páginasSOP: Manifestações da Síndrome do Ovário PolicísticoGeisaAinda não há avaliações
- Sop - Acn PDFDocumento109 páginasSop - Acn PDFrlibia14Ainda não há avaliações
- Hormônios Femininos Ciclo Menstrual MenopausaDocumento37 páginasHormônios Femininos Ciclo Menstrual MenopausathaiseAinda não há avaliações
- Mitologia dos orixás de PrandiDocumento8 páginasMitologia dos orixás de PrandiCláudio Henrique de Souza0% (1)
- Sindrome Dos Ovários PolicisticosDocumento5 páginasSindrome Dos Ovários PolicisticosCarolina AzevedoAinda não há avaliações
- E Book Fitoter - Picos Na SOP PDFDocumento20 páginasE Book Fitoter - Picos Na SOP PDFNatasha67% (3)
- (TEORIA) NESTAREZ, Oscar. Poe e Lovecraft - Um Ensaio Sobre o Medo Na LiteraturaDocumento98 páginas(TEORIA) NESTAREZ, Oscar. Poe e Lovecraft - Um Ensaio Sobre o Medo Na Literaturasamuelufpb201901Ainda não há avaliações
- A Caverna Na Neve A Jornada de Tenzin PalmoDocumento212 páginasA Caverna Na Neve A Jornada de Tenzin PalmoErica Arraes100% (3)
- Hormônios: características e funçõesDocumento88 páginasHormônios: características e funçõesClaudio Lobato100% (2)
- Curso Basico DepilacaoDocumento23 páginasCurso Basico DepilacaoJulissa Mello100% (1)
- AMENORREIA Resumo InternetDocumento6 páginasAMENORREIA Resumo InternetNataliaBiliaAinda não há avaliações
- Charlene Hartnady - O Programa 01 - Uma Companheira para York (AFDP)Documento189 páginasCharlene Hartnady - O Programa 01 - Uma Companheira para York (AFDP)Elis Angela PereiraAinda não há avaliações
- Exame Papanicolau: procedimentos e indicaçõesDocumento33 páginasExame Papanicolau: procedimentos e indicaçõesPâmela BuenoAinda não há avaliações
- SOP - Diagnóstico, fisiopatologia e abordagem da síndrome dos ovários policísticosDocumento9 páginasSOP - Diagnóstico, fisiopatologia e abordagem da síndrome dos ovários policísticosIagoAlmeidaAinda não há avaliações
- MARC 3 - Amenorreia e SOPDocumento4 páginasMARC 3 - Amenorreia e SOPkpkc768627Ainda não há avaliações
- Síndrome Dos Ovários Polissisticos - Hermes PardiniDocumento7 páginasSíndrome Dos Ovários Polissisticos - Hermes PardininelsonAinda não há avaliações
- SOP sintomas causas tratamentoDocumento4 páginasSOP sintomas causas tratamentoN U M BAinda não há avaliações
- Síndrome Do Ovário Policístico - SOPDocumento45 páginasSíndrome Do Ovário Policístico - SOPBárbara TauannaAinda não há avaliações
- Resumo Artigo SOPDocumento2 páginasResumo Artigo SOPcamila rodriguesAinda não há avaliações
- Síndrome Dos Ovários PolicísticosDocumento2 páginasSíndrome Dos Ovários PolicísticosMaria Helena MartinsAinda não há avaliações
- Sindrome de Ovarios Poliquisticos NoelmaDocumento14 páginasSindrome de Ovarios Poliquisticos NoelmaRichard AdrianoAinda não há avaliações
- Fisiopatologia SopDocumento12 páginasFisiopatologia SopJoão MonteiroAinda não há avaliações
- Gonada FemininaDocumento20 páginasGonada FemininaPâmela CristinaAinda não há avaliações
- SEMINARIO ReprodutorDocumento65 páginasSEMINARIO ReprodutorAilson SilvaAinda não há avaliações
- SÍNDROME DOS OVÁRIOS POLICÍSTICOS - ResumoDocumento4 páginasSÍNDROME DOS OVÁRIOS POLICÍSTICOS - ResumoAmanda SouzaAinda não há avaliações
- HiperinsulinemiaDocumento16 páginasHiperinsulinemiaFernando ArataqueAinda não há avaliações
- Síndrome Dos Ovários PolicísticosDocumento5 páginasSíndrome Dos Ovários PolicísticosMarcos Fernando Neiva De Alencar Lustosa RochaAinda não há avaliações
- Climatério e Menopausa: Sinais, Sintomas e FisiologiaDocumento6 páginasClimatério e Menopausa: Sinais, Sintomas e FisiologiaRayssa GarciaAinda não há avaliações
- SOP: sinais, causas e tratamentoDocumento10 páginasSOP: sinais, causas e tratamentoSandro EspíndolaAinda não há avaliações
- Aula 17. GonadasDocumento18 páginasAula 17. GonadasLouwiz Khalifah NegroAinda não há avaliações
- Síndrome Dos Ovários PolicísticosDocumento3 páginasSíndrome Dos Ovários PolicísticosFlávia FreireAinda não há avaliações
- Aula 1 - LPF - Síndrome Do Ovário Policístico e A Resistência À Insulina MÓD CDocumento2 páginasAula 1 - LPF - Síndrome Do Ovário Policístico e A Resistência À Insulina MÓD Cgabriella.ferreira.inacioAinda não há avaliações
- Introdução Sindrome Do Ovário PolicisticoDocumento9 páginasIntrodução Sindrome Do Ovário PolicisticojoaquimmatchaiAinda não há avaliações
- Anovulação e Síndrome de Ovários PoliquísticosDocumento36 páginasAnovulação e Síndrome de Ovários PoliquísticosEliotélioMirandaNhamicoleAinda não há avaliações
- SOP.pptDocumento28 páginasSOP.pptgustavo hitzschkysAinda não há avaliações
- Síndrome dos Ovários Policísticos: Definição, Diagnóstico e TratamentoDocumento19 páginasSíndrome dos Ovários Policísticos: Definição, Diagnóstico e TratamentoClara CunhaAinda não há avaliações
- 050 Síndrome Do Ovário PolicísticoDocumento6 páginas050 Síndrome Do Ovário PolicísticoJonathan P SilvaAinda não há avaliações
- Avaliação hormonal masculina e femininaDocumento6 páginasAvaliação hormonal masculina e femininaAna Carolina Martins SantanaAinda não há avaliações
- Aula AmenorréiaDocumento39 páginasAula AmenorréiaSâmela VianaAinda não há avaliações
- Aula 03 - SÍNDROMES HIPERANDROGENICASDocumento12 páginasAula 03 - SÍNDROMES HIPERANDROGENICASAlisson MatheusAinda não há avaliações
- Sintomas, diagnóstico e complicações da menopausaDocumento4 páginasSintomas, diagnóstico e complicações da menopausaFELIPE EMANUEL BASNIAK DA SILVA (A)Ainda não há avaliações
- INFERTILIDADEDocumento5 páginasINFERTILIDADEVanessa LucenaAinda não há avaliações
- Resumo Aula SOPDocumento5 páginasResumo Aula SOPAnanda Gimenez OberthirAinda não há avaliações
- Problema 1 - AberturaDocumento13 páginasProblema 1 - AberturaKennyson Damm SepúlvidaAinda não há avaliações
- Hipogonadismo: causas, sintomas e tratamento da baixa produção de hormônios sexuaisDocumento5 páginasHipogonadismo: causas, sintomas e tratamento da baixa produção de hormônios sexuaisJuliana Silva100% (1)
- Ovário Policístico - Sintomas Causas e Tratamento - MD - SaúdeDocumento12 páginasOvário Policístico - Sintomas Causas e Tratamento - MD - SaúdeGilson Santana de OliveiraAinda não há avaliações
- Complicações Clínicas Da AnorexiaDocumento5 páginasComplicações Clínicas Da Anorexialinhamarques100% (1)
- Menopausa e EnvelhecimentoDocumento42 páginasMenopausa e EnvelhecimentoDanni Menezes100% (1)
- Resumo de Ginecologia GeralDocumento49 páginasResumo de Ginecologia GeralAna Fernanda Fagundes GonçalvesAinda não há avaliações
- Síndrome Do ClimatérioDocumento5 páginasSíndrome Do ClimatérioFLAVIA DE SOUZA ARAUJOAinda não há avaliações
- Menopausa UnifapDocumento7 páginasMenopausa Unifapnauamy brunoAinda não há avaliações
- Resumo Ginecologia 1 ProvaDocumento21 páginasResumo Ginecologia 1 ProvaNatalia Yumi Yamamoto100% (7)
- Manual nutricional SOP trata alimentosDocumento5 páginasManual nutricional SOP trata alimentosJuliana AraújoAinda não há avaliações
- Trabalho Reprodução Pequenos N2-1Documento5 páginasTrabalho Reprodução Pequenos N2-1Elígia MouraAinda não há avaliações
- Capítulo 49 - Puberdade PrecoceDocumento3 páginasCapítulo 49 - Puberdade PrecocelarissatelesmartinsAinda não há avaliações
- Amenorreia: causas e abordagemDocumento14 páginasAmenorreia: causas e abordagemRafaelAinda não há avaliações
- Hemorragia Uterina DisfuncionalDocumento34 páginasHemorragia Uterina DisfuncionalFenias BoaneAinda não há avaliações
- Endocrinologia FemininaDocumento11 páginasEndocrinologia FemininaDaniel Soeiro Da S. DantasAinda não há avaliações
- Hiperandrogenismo Guias Clinicas SEfDocumento20 páginasHiperandrogenismo Guias Clinicas SEfzrmswgz2t7Ainda não há avaliações
- ANDROPAUSADocumento5 páginasANDROPAUSApoxaAinda não há avaliações
- Puberdade Tardia - Manual de Orientação para Diagnóstico e TratamentoDocumento5 páginasPuberdade Tardia - Manual de Orientação para Diagnóstico e TratamentoOderci FilhoAinda não há avaliações
- Síndrome de Sheehan e HipopituitarismoDocumento60 páginasSíndrome de Sheehan e HipopituitarismoCristiano Augusto Cintra PiresAinda não há avaliações
- Sade Da Mulher - Planejamento Familiar e AbortoDocumento22 páginasSade Da Mulher - Planejamento Familiar e AbortoPâmela BuenoAinda não há avaliações
- Doença inflamatória pélvica: causas, sintomas e tratamentoDocumento4 páginasDoença inflamatória pélvica: causas, sintomas e tratamentoPâmela BuenoAinda não há avaliações
- Descrio de Exame FsicoDocumento3 páginasDescrio de Exame FsicoPâmela BuenoAinda não há avaliações
- Fundamentos da Teologia Parte 1Documento80 páginasFundamentos da Teologia Parte 1Marquislei Martins MarquesAinda não há avaliações
- NCM Classifica - Fiscal ABIROCHAS PDFDocumento7 páginasNCM Classifica - Fiscal ABIROCHAS PDFFernando Alves da SilvaAinda não há avaliações
- Lei 13331 2016 1Documento3 páginasLei 13331 2016 1IFPB DAPAinda não há avaliações
- TCC Ana Luíza - Projeto de MonografiaDocumento19 páginasTCC Ana Luíza - Projeto de MonografiaAna Luíza RibeiroAinda não há avaliações
- APR - HO Betonpoxi - GHE Xls 1Documento18 páginasAPR - HO Betonpoxi - GHE Xls 1Watch Face FreeAinda não há avaliações
- Embargos de declaração para sanar omissão em decisãoDocumento4 páginasEmbargos de declaração para sanar omissão em decisãoLázaroRobertoMoreiraLimaAinda não há avaliações
- Material de ApoioDocumento76 páginasMaterial de ApoioCaroline Queiroz50% (2)
- Endereços Da Companhia BRDocumento14 páginasEndereços Da Companhia BRAfonso OliverAinda não há avaliações
- Análise de Capacidade de Carga de Estacas Hélice Contínua Na Região Metropolitana Do RecifeDocumento10 páginasAnálise de Capacidade de Carga de Estacas Hélice Contínua Na Região Metropolitana Do Recifeclaiton mesacasaAinda não há avaliações
- Grade Horaria - 1o Semestre 2023 4Documento1 páginaGrade Horaria - 1o Semestre 2023 4Lucas KaueAinda não há avaliações
- Cms Files 194115 1637064036bibilia CFP Nov 21 - Oficial CompressedDocumento209 páginasCms Files 194115 1637064036bibilia CFP Nov 21 - Oficial CompressedClovis PetroceliAinda não há avaliações
- Sistema de Lógica, John Stuart Mill, Parte 1Documento673 páginasSistema de Lógica, John Stuart Mill, Parte 1Anonymous QPWsZkAinda não há avaliações
- Agência Tech serviços assessoria imprensaDocumento14 páginasAgência Tech serviços assessoria imprensaGiva AlexandreAinda não há avaliações
- ANEEL Chamada PeD ArmazenamentoDocumento9 páginasANEEL Chamada PeD ArmazenamentoThomas CamposAinda não há avaliações
- Agente-Combate SJC Preliminar Isencao DeferidaDocumento2 páginasAgente-Combate SJC Preliminar Isencao DeferidaAlencar TrindadeAinda não há avaliações
- Peça Teatral Igreja CatólicaDocumento4 páginasPeça Teatral Igreja Católicabatist40011Ainda não há avaliações
- Principais Considerações Sobre o Estatuto Da Criança e Do AdolescenteDocumento4 páginasPrincipais Considerações Sobre o Estatuto Da Criança e Do AdolescenteFábio BittencourtAinda não há avaliações
- Vestiba QUIM. RADIOATIVADocumento2 páginasVestiba QUIM. RADIOATIVAju_juprincesinhaAinda não há avaliações
- Alexandre Escola Da PonteDocumento12 páginasAlexandre Escola Da PonteVania OrsioliAinda não há avaliações
- O Espírito Santo na vida cristãDocumento2 páginasO Espírito Santo na vida cristãJosé MorenoAinda não há avaliações
- 2 PlatãoDocumento8 páginas2 PlatãoManoel Cleber Sampaio SilvaAinda não há avaliações
- Funções de LinguagemDocumento9 páginasFunções de LinguagemGEOVANNA ALVES DAVID RIBEIROAinda não há avaliações
- Resolução CONAMA Nº 005 de 15 de Junho de 1989.Documento6 páginasResolução CONAMA Nº 005 de 15 de Junho de 1989.Victor DiasAinda não há avaliações
- Frequencias Tabelas Graficos ResolDocumento11 páginasFrequencias Tabelas Graficos ResolBruno PintoAinda não há avaliações
- Jornaldeletras 1248Documento40 páginasJornaldeletras 1248Ágata CristinaAinda não há avaliações