Escolar Documentos
Profissional Documentos
Cultura Documentos
Estudo Dirigido
Enviado por
Ana Carolina AráujoDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estudo Dirigido
Enviado por
Ana Carolina AráujoDireitos autorais:
Formatos disponíveis
Engenharia Bioquímica
Prof. Ana Souza
ALUNOS: ANA CAROLINA ARAÚJO E YAN VALDEZ
ESTUDO DIRIGIDO
1) Compare os dissacarídeos maltose e sacarose, identificando a ligação
glicosídica em cada caso. Por que maltose é redutora e sacarose não é.
RESPOSTA: Maltose é um dissacarídeo contém dois resíduos de D-glicose unidos por
uma ligação glicosídica entre o C-1 (o carbono anomérico) de um resíduo de glicose e o
C-4 do outro. A sua ligação se dar pela junção de uma molécula de α-D- glicose e outra
de β-D-glicose. A sacarose é um dissacarídeo formado pela ligação glicosídica entre uma
glicose e uma frutose e não é um carboidrato sintetizado por animais.
A oxidação de um açúcar pelo íon cúprico (a reação que define um açúcar redutor)
ocorre apenas com a forma linear, a qual existe em equilíbrio com as formas cíclicas.
Quando o carbono anomérico está envolvido em uma ligação glicosídica, ou seja, quando
o composto for um acetal ou cetal completo. Logo, a fácil inter-conversão entre as formas
lineares e cíclicas é impedida. Como o carbono do carbonil pode ser oxidado somente
quando o açúcar estiver em sua forma linear, a formação de uma ligação glicosídica gera
um açúcar não redutor. Como na estrutura do carboidrato maltose conserva um carbono
anomérico livre (o C-1 do resíduo de glicose à direita, a maltose é um açúcar redutor. E
como a sacarose não contém um átomo de carbono anomérico livre; os carbonos
anoméricos de ambas as unidades monossacarídicas estão envolvidos na ligação
glicosídica. A sacarose é, assim, um açúcar não redutor, e sua estabilidade frente à
oxidação a torna uma molécula adequada para o armazenamento e o transporte de energia
em plantas
2) Analise a estrutura do glicogênio. Procure destacar as vantagens e
desvantagens da função deste polímero como composto de reserva
energética.
RESPOSTA: O glicogênio é o principal polissacarídeo de armazenamento das células
animais. Quando o glicogênio é utilizado como fonte de energia, as unidades de glicose
são removidas uma de cada vez a partir da extremidade não redutora.
Vantagens do glicogênio
Reduz a osmolaridade pois resulta num número menor de partículas em solução. A
degradação controlada e a liberação da glicose: aumenta a glicose disponível entre as
refeições. O glicogênio é um tampão para manter os níveis de glicose sanguínea. Além
disso, é importante pois o cérebro só utiliza glicose a não ser em jejum prolongado.
Glicose do glicogênio é rapidamente liberada, o que é importante na atividade extrema e
repentina. Glicose liberada pode fornecer energia na anaerobiose.
Desvantagens do glicogênio
Engenharia Bioquímica
Prof. Ana Souza
Uma das desvantagens do uso do glicogênio é que por ser uma molécula muito hidrata,
possuindo muito (OH), ela tem muitas ramificações que aumentam a solubilidade e
velocidade de síntese e degradação dos grânulos.
3) Classificar os aminoácidos em termos da natureza química dos seus
grupos radicais:
a) ionizáveis ou não ionizáveis,
Resposta: alanina, é um ácido diprótico quando completamente protonado; ele tem dois
grupos, o grupo -COOH e o grupo NH3+, que pode produzir dois prótons
b) ácidos ou básicos:
Resposta: Grupos R carregados negativamente (ácidos). Os dois aminoácidos que
apresentam grupos R com carga negativa final em pH 7,0 são o aspartato e o glutamato,
cada um dos quais tem um segundo grupo carboxila
Os aminoácidos nos quais os grupos R têm uma carga positiva significativa em pH 7,0
(básico) são Lisina, a arginina e a histidina,
c) polares ou não polares:
Resposta: Grupos R – polares não carregados: Serina, treonina, cisteína, asparagina,
glutamina. Os grupos R desses aminoácidos são mais solúveis em água, ou mais
hidrofílicos do que aqueles dos aminoácidos apolares, porque eles contêm grupos
funcionais que formam ligações de hidrogênio com a água.
d) hidrofílicos ou hidrofóbicos:
Resposta: Grupo R apolares- Os grupos R nesta classe de aminoácidos são apolares e
hidrofóbicos são estes a Glicina, Alanina, Valina, leucina, Isoleucina, metionina e prolina
e) alifáticos ou aromáticos:
Resposta: Grupos R aromáticos Fenilalanina, tirosina e triptofano, com suas cadeias
laterais aromáticas, são relativamente apolares (hidrofóbicos).
f) lineares ou ramificados:
Ramificados formamdipeptídeo, tripeptídeo
4) Defina estrutura primária, secundária, terciária e quaternária de uma
proteína, dando exemplos.
Engenharia Bioquímica
Prof. Ana Souza
Resposta: A estrutura primária consiste em uma sequência de aminoácidos unidos por
ligações peptídicas e inclui quaisquer pontes dissulfeto. Cadeia formada por aminoácido.
A estrutura secundária se refere a arranjos particularmente estáveis de resíduos de
aminoácidos dando origem a padrões estruturais recorrentes, pode ser de α-hélice ou β-
folha pregueada, como por exemplo o Colágeno. A estrutura terciária descreve todos os
aspectos do enovelamento tridimensional de um polipeptídeo, como a Mioglobina e
glicólise triose fosfato isomerase. E quando uma proteína tem duas ou mais subunidades
polipeptídicas, seus arranjos no espaço são chamados de estrutura quaternária, como no
caso da Hemoglobina
5) Descreva a experiência clássica de Anfinsen com a enzima ribonuclease
A, indicando sua conclusão principal. Qual o papel das pontes de
dissulfeto na manutenção da estrutura nativa (terciária) da ribonuclease?
Conceitue estrutura nativa e desnaturação de proteínas, mostrando o que
isso tem a ver com a atividade enzimática da ribonuclease A. Que função
termodinâmica promove espontaneamente a transição da ribonuclease de
desnaturada para nativa?
RESPOSTA: Os experimentos de Anfinsen demonstraram que a ribonuclease, depois de
desenovelada quimicamente pela adição de um agente desnaturante, poderia se enovelar
espontaneamente após serem reestabelecidas as condições fisiológicas (retirada do agente
desnaturante) e, desta forma, retornar ao seu estado nativo. Anfinsen concluiu neste
estudo que a sequência de resíduos de aminoácidos contém a informação necessária para
caracterizar o estado nativo de uma proteína e guiar seu processo de enovelamento. Com
os estudos sobre a desnaturação da ribonuclease, Anfinsen também estabeleceu a qual foi
chamada de "Hipótese Termodinâmica". Esta hipótese sugere que a proteína no seu estado
nativo deve possuir o valor mínimo de energia livre de Gibbs. Assim, o estudo do
enovelamento de proteínas começou a ser visto, não apenas como uma questão biológica,
mas como uma questão de minimização de energia livre.
6) Duas proteínas, apesar de terem diferenças quanto a alguns de seus
aminoácidos, são capazes de desempenhar a mesma função. Explique
como isto é possível.
RESPOSTA: Para determinada proteína, os resíduos de aminoácidos essenciais para a
atividade da proteína são conservados ao longo do tempo evolutivo.
Comparando proteínas funcionalmente semelhantes de diferentes espécies, foi descoberto
que essas proteínas frequentemente têm sequências de aminoácidos semelhantes.
Portanto, uma ligação íntima entre a estrutura primária das proteínas e suas funções é
evidente.
O fator de transferência gênica horizontal em que os genes transferidos podem ser muito
semelhantes aos genes dos quais eles foram derivados no organismo original, enquanto a
Engenharia Bioquímica
Prof. Ana Souza
maior parte dos outros genes nos mesmos dois organismos podem estar relacionados de
modo muito distante. Por exemplo, uma proteína chamada de EF-1α (fator de
alongamento 1α) está envolvida na síntese de proteínas em todos os eucariontes. Uma
proteína semelhante, EF-Tu, com a mesma função é encontrada em bactérias. As
semelhanças na sequência e na função indicam que a EF-1α e a EF-Tu são membros de
uma família de proteínas que compartilham um ancestral comum.
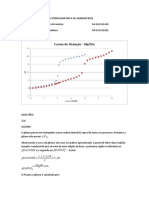
7) As velocidades de uma reação enzimática foram determinadas para
diversas
Concentrações de substrato, conforme a tabela abaixo:
Os gráficos de, respectivamente, V em função de [S] e 1/V em função de 1/[S]
podem servir para determinar Km e Vmax? Como?
RESPOSTA: O gráfico S e V podem determinar o KM , que é a constante de Michaelis-
Menten, e VMAX , que representa a velocidade máxima de conversão, através de
aproximações com limites e integrais, pois a velocidade máxima é alcançada quando o
substrato tende a infinito ou 1/0 (que é uma impossibilidade matemática), e
semelhantemente, quando a velocidade tende a infinito ou 1/0 o substrato chega ao valor
de KM como observa-se no Gráfico 1, toda via pode-se tirar uma aproximação tendo a
velocidade máxima e a dividindo por dois para chegar a um valor próximo de KM.
Engenharia Bioquímica
Prof. Ana Souza
160,0000
140,0000
120,0000
VELOCIDADE
100,0000
80,0000
y = 32,267ln(x) - 30,947
60,0000
40,0000 R² = 0,9907
20,0000
0,0000
0,0000 50,0000 100,0000 150,0000 200,0000 250,0000
SUBSTRATO
Quando invertemos os valores de velocidade e substrato no gráfico de 1/V em função
de 1/[S] lineariza-se a curva de modo a retirar as impossibilidades de cogitação e ser
possível determinar valores. Assim, quando 1/[S] tende a zero determina-se a o inverso
da velocidade máxima e quando 1/V tende a zero determina-se o oposto e inverso da
constante KM , formando o padrão no Gráfico, e quando transforma-se de volta para
gráfico normal obter-se os valores corretos de forma mais simplificada, nesse caso, Km
= 32,1475 µM e Vmax = 163,9344 µmoles *L-1*min-1.
0,0500
0,0400 y = 0,196x + 0,0061
R² = 0,9996
VELOCIDADE^-1
0,0300
0,0200
0,0100
0,0000
-0,0500 0,0000 0,0500 0,1000 0,1500 0,2000 0,2500
-0,0100
SUBSTRATO^-1
8) Numa reação enzimática, o valor de Vmax, mas não o de Km é
diretamente proporcional à concentração da enzima? Justifique.
RESPOSTA: O KM é uma medida da estabilidade do complexo enzima-substrato, desse
modo, é um valor associado a capacidade de conversão de substrato o que explica sua
tendência quando a velocidade tende a 1/0 a revelasse-se em um valor especifico para
cada sistema. Portanto, o Km não é função da concentração de substrato por que tem o
significado de um valor de substrato para qual a velocidade é matematicamente é infinita,
logo representando o substrato em um momento especifico da reação de conversão que a
Engenharia Bioquímica
Prof. Ana Souza
literatura, afirma -ser a no momento em que a velocidade de conversão atinge a sua
metade, e não podendo ser diretamente relacionado ao substrato mas ao sistema em sí.[1]
9) O que são enzimas alostéricas? Defina utilizando-se de gráficos
esquemáticos de V em função de [S], compare uma enzima michaeliana
com uma enzima alostérica positiva e com uma enzima alostérica negativa.
RESPOSTA: Uma proteína alostérica é aquela em que a interação com um ligante em
um sítio afeta as propriedades de ligação de outro sítio na mesma proteína. O termo
“alostérico” deriva do grego allos, “outro”, e stereos, “sólido” ou “forma”. Proteínas
alostéricas são as que têm “outras formas”, ou conformações, induzidas pela interação
com ligantes denominados moduladores. A mudança conformacional induzida pelo(s)
modulador(es) interconverte formas mais ativas e menos ativas da proteína. Quando o
ligante normal e o modulador são idênticos, a interação é chamada de homotrópica.
Quando o modulador é uma molécula diferente do ligante normal, a interação é
heterotrópica. Algumas proteínas têm dois ou mais moduladores e, em função disso,
podem participar de interações homotrópicas e heterotrópicas. [1]
No metabolismo celular, grupos de enzimas trabalham conjuntamente em vias
sequenciais para realizar um determinado processo metabólico, como a degradação da
glicose a lactato por uma série de reações ou as muitas reações da síntese de aminoácidos
a partir de precursores simples. Nesses sistemas enzimáticos, o produto da reação de uma
enzima é o substrato da enzima seguinte. Cada via, entretanto, inclui uma ou mais enzimas
que influenciam em muito a velocidade de toda a sequência de reações. O Ajuste na
velocidade das reações catalisadas por enzimas regulatórias e, portanto, ajustes na
velocidade da sequência metabólica inteira permitem que as células atendam às
necessidades de energia e das biomoléculas de que precisam para crescer e se manter. [1]
As atividades das enzimas regulatórias são moduladas de várias maneiras. Enzimas
alostéricas agem por meio de ligações reversíveis e não covalentes com compostos
regulatórios denominados moduladores alostéricos ou efetores alostéricos, que
geralmente são metabólitos pequenos ou cofatores. Nesse contexto, as enzimas alostericas
são capazes modificar a própria a atividade catalítica dependendo de moléculas
moduladoras. Quando o efeito é positivo a atividade catalítica aumentar por consequente
a velocidade, se o efeito é negativo ocorre o oposto. Analisando o gráfico de V em função
de [S] para enzimas alostéricas, a curva apresentara um comportamento sigmoide, ou
seja cresse ou descresse com uma tendência logarítmica assintótica ou hipérbole
assímptota, no qual o valor da constante KM que seria a metade da velocidade máxima,
não é necessariamente encontrado da mesma forma que é determinado como nas enzimas
Michaelianas. [1]
10) Quanto aos nucleotídeos, responda:
a) O que são nucleotídeos?
Engenharia Bioquímica
Prof. Ana Souza
RESPOSTA: Os nucleotídeos são as moedas energéticas nas transações metabólicas. Os
nucleotídeos são os constituintes dos ácidos nucleicos: ácido desoxirribonucleico (DNA)
e ácido ribonucleico (RNA), os repositórios moleculares da informação genética.
b) Qual papel desempenham?
RESPOSTA: Os nucleotídeos desempenham diversas funções biológicas. Por serem
constituintes do DNA E RNA eles tem a função no armazenamento e na transmissão da
informação genética. Atuam nas reações de transferência de energia química nas células,
são componentes estruturais de cofatores enzimáticos e atuam como segundos
mensageiros.
c) Como é que as proteínas são produzidas na célula a partir da
informação no código genético.
RESPOSTA: A partir da síntese proteica. A síntese proteica é um processo
biológico no qual a informação que está presente no DNA da célula é transformada em
proteínas. A síntese proteica ocorre em 3 etapas: transcrição; ativação e tradução.
Na primeira etapa, uma enzima presente a (RNA-polimerase) vai se ligar a uma
extremidade da molécula de DNA do gene. Quando isso acontece, quebram-se as ligações
de hidrogênio entre as bases nitrogenadas das duas fitas do DNA, a estrutura de dupla-
hélice se desfaz e as fitas se separam. Depois, a RNA-polimerase começa a sintetizar uma
molécula de RNAm, isto é, RNA mensageiro. Para isso, a sequência de bases
nitrogenadas da fita do DNA é lida, modelando a sequência do RNAm com bases
complementares.
Na segunda etapa, o RNAt, ou RNA transportador, leva os aminoácidos que estão
soltos no citoplasma da célula até o ribossomo. Para que o RNAt reconheça em que parte
do RNAm devem ser deixados os aminoácidos, ele tem uma sequência de três bases
complementares ao códon do RNAm, chamada de anticódon. Nesse processo de
transporte, a célula consome ATP.
Na terceira etapa Na terceira etapa, o RNAm é decodificado pelo ribossomo.
Para que isso aconteça, são necessários três momentos distintos. Nesse momento, o
ribossomo, o RNAm e um RNAt especial se associam. O RNAt transporta o aminoácido
metionina, e contém o anticódon UAC, necessário para emparelhar com o códon AUG
do RNAm, que é o responsável por determinar onde a informação para a cadeia peptídica
tem início.
11) As membranas biológicas são compostas por proteínas associadas a
uma matriz de bicamada lipídica. Frente a isso, esquematize uma
membrana celular e aponte as estruturas e cada uma de suas funções.
Engenharia Bioquímica
Prof. Ana Souza
RESPOSTA: Membrana plasmática é formada basicamente por lipídios e proteínas,
sendo aqueles mais relacionados com a parte estrutural da membrana e estas relacionadas
com as várias funções exercidas por ela.
Camada Fosfolipídica
Os lipídios que formam essas bicamadas são basicamente os fosfolipídios, os quais se
destacam por apresentarem uma região hidrofóbica estando no centro da membrana e
uma região hidrofílica que estão nas superfícies externa e interna da membrana.
Proteínas: encaixadas entre os fosfolipídios com diversas funções.
Moléculas de colesterol: relacionadas a maior ou menor fluidez da membrana.
Glicoálix: Na região mais externa da membrana plasmática, é possível observar
uma área denominada glicocálice ou glicocálix. São glicoproteínas são
carboidratos e proteínas. E os glicolipídios são formados por carboidratos e
lipídios. O glicocálix tem como a função a proteção da membrana plasmática e o
reconhecimento celular de um mesmo tecido.
12) Escolha um microrganismo e responda:
a) Quais características esse microrganismo apresenta?
RESPOSTA: Saccharomyces cerevisiae é um organismo eucariota unicelular que
pertence ao reino dos Fungos.
b) Quais aplicações tecnológicas dele em bioprocessos? Apresente um
diagrama de blocos do bioprocesso.
Engenharia Bioquímica
Prof. Ana Souza
RESPOSTA: A S. Cerevisiae pode ser aplicada em vários processos biotecnológicos,
visto que é bastante em empregada na produção do pão e também da cerveja, além de ser
usada para a produção de etanol cachaça e combustível.
Fermentação Alcoólica
REFERÊNCIAS
NELSON, D. L. et al. Princípios de bioquímica de Lehninger. 6. ed. [s.l.] artmed,
2014.
CONTESSOTO, V. G. et al. Introduction to the Protein Folding Problem: An
Approach Using Simplified Computational Models.Disponível em: <
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1806-11172018000400407
>.Acesso em: 21 de abril. 2020.
Você também pode gostar
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações
- MODULO 3 BiologiaDocumento146 páginasMODULO 3 BiologiaMARINA NhambeAinda não há avaliações
- Resumo Lehninger - P2Documento21 páginasResumo Lehninger - P2Rafaella VolpiAinda não há avaliações
- VegetarianismoDocumento109 páginasVegetarianismoFernando Santos100% (1)
- Estudo Dirigido 02 - Ligação PeptÍdica e Propriedades Dos Peptídeos (Nota 90 de 100)Documento9 páginasEstudo Dirigido 02 - Ligação PeptÍdica e Propriedades Dos Peptídeos (Nota 90 de 100)Emmanuelle FernandesAinda não há avaliações
- Topologia dos Principais Transportadores de Açúcares: uma abordagem sobre a estrutura e função dos GLUT'sNo EverandTopologia dos Principais Transportadores de Açúcares: uma abordagem sobre a estrutura e função dos GLUT'sAinda não há avaliações
- Apostila Bioquímica Atualizada Com Prática de TitulaçãoDocumento46 páginasApostila Bioquímica Atualizada Com Prática de TitulaçãoDoug MartinsAinda não há avaliações
- Relatório - Exp2 - Aminoácidos - Transformações Bioquimicas - Trim2.1Documento14 páginasRelatório - Exp2 - Aminoácidos - Transformações Bioquimicas - Trim2.1Fernando Henrique G. Zucatelli100% (3)
- Exercícios de MetabolismoDocumento10 páginasExercícios de MetabolismoAngela Rogerio100% (1)
- PROVA PMBQBM Final 2017Documento9 páginasPROVA PMBQBM Final 2017Daniel LoboAinda não há avaliações
- Exercícios Introdução Ao MetabolismoDocumento13 páginasExercícios Introdução Ao MetabolismoanaAinda não há avaliações
- Ficha de Revisão - Biologia 10Documento13 páginasFicha de Revisão - Biologia 10Beatriz SantosAinda não há avaliações
- Relatório Glicose Método Dns - IFRJDocumento11 páginasRelatório Glicose Método Dns - IFRJLucas MoreiraAinda não há avaliações
- Cola P2Documento3 páginasCola P2zepaflaAinda não há avaliações
- GDs Respondidos 2009 - 2-MedicinaDocumento95 páginasGDs Respondidos 2009 - 2-MedicinaCarolina Gorza0% (1)
- Bioquímica e Anatomia HumanaDocumento14 páginasBioquímica e Anatomia HumanaLucilaAinda não há avaliações
- Glucidos 1 - Definicao e ClassificacaoDocumento35 páginasGlucidos 1 - Definicao e ClassificacaoJoana VieiraAinda não há avaliações
- Estudo Dirigido de BioquímicaDocumento7 páginasEstudo Dirigido de BioquímicaLARISSA SUZANA DE SOUZA TERRAAinda não há avaliações
- Avaliação de Laboratório em Bioquímica - Thiago Amorim - 414641Documento6 páginasAvaliação de Laboratório em Bioquímica - Thiago Amorim - 414641Thiago AmorimAinda não há avaliações
- Trabalho de BioquímicaDocumento5 páginasTrabalho de BioquímicaJéssica AlmeidaAinda não há avaliações
- Atividade 01 - Via Glicolítica e Destinos Do Piruvato VITOR PDFDocumento9 páginasAtividade 01 - Via Glicolítica e Destinos Do Piruvato VITOR PDFEdilene MatosAinda não há avaliações
- Lista 2. 2021.2Documento4 páginasLista 2. 2021.2jhgfvdcsxAinda não há avaliações
- Clase 1-ProteinasDocumento41 páginasClase 1-Proteinasflorencia9609Ainda não há avaliações
- Química Da CélulaDocumento21 páginasQuímica Da CélulaJoão Henrique Araújo BatistaAinda não há avaliações
- REVISÃO 1 - ProteínasDocumento17 páginasREVISÃO 1 - ProteínasGlenda FrançaAinda não há avaliações
- GD CertoDocumento12 páginasGD CertoAna Clara BicalhoAinda não há avaliações
- Bioquímica 3Documento8 páginasBioquímica 3HansMikuAinda não há avaliações
- Fundamentos de BioquímicaDocumento66 páginasFundamentos de BioquímicaMJTAinda não há avaliações
- Notas e Resumos de BioquímicaDocumento17 páginasNotas e Resumos de BioquímicalsugarleuAinda não há avaliações
- Resumo Bioquímica-EnzimasDocumento2 páginasResumo Bioquímica-EnzimasBruna Soares de SáAinda não há avaliações
- Lista - Avaliação 1 ResolvidaDocumento6 páginasLista - Avaliação 1 ResolvidatamiossopolianaAinda não há avaliações
- Lista de Exercícios 1 - BioquímicaDocumento7 páginasLista de Exercícios 1 - BioquímicaCamilly Rosa AlvesAinda não há avaliações
- Perguntas e Respostas Ferramenta I 2011.2Documento7 páginasPerguntas e Respostas Ferramenta I 2011.2bertinhacamposAinda não há avaliações
- ED - Tampão - Aminoácidos - 2021.1Documento3 páginasED - Tampão - Aminoácidos - 2021.1Leticia CamargoAinda não há avaliações
- Apostila Vet 2014Documento49 páginasApostila Vet 2014William E Rúbia AbrantesAinda não há avaliações
- Relatório 01 - Propriedades Acido-Base de AminoacidosDocumento7 páginasRelatório 01 - Propriedades Acido-Base de AminoacidosPedro MarizAinda não há avaliações
- Apostila Enade cc638784cfDocumento161 páginasApostila Enade cc638784cfAna Maria FerrariAinda não há avaliações
- Apostila Exercicios VetDocumento49 páginasApostila Exercicios VetJoana Paula100% (2)
- Lista de Exercício - Aminoácidos e ProteínasDocumento2 páginasLista de Exercício - Aminoácidos e ProteínasJônatas Franco100% (1)
- Lista de ExercíciosDocumento7 páginasLista de ExercíciosPoliana SenaAinda não há avaliações
- Metabolismo Das Proteínas, Síntese, Ciclo Da Ureia e IcteríciaDocumento35 páginasMetabolismo Das Proteínas, Síntese, Ciclo Da Ureia e IcteríciaLaila LongenAinda não há avaliações
- Bioquimica 10-20Documento11 páginasBioquimica 10-20Isabelle SousaAinda não há avaliações
- 73 A 76 - Resumo - Constituintes Orgânicos Das CélulasDocumento12 páginas73 A 76 - Resumo - Constituintes Orgânicos Das CélulasmimargAinda não há avaliações
- Wa0001Documento12 páginasWa0001kokmerpqAinda não há avaliações
- Resumo Aminoácidos e ProteínasDocumento4 páginasResumo Aminoácidos e ProteínasIngrid OliveiraAinda não há avaliações
- Atividade de BioquímicaDocumento4 páginasAtividade de BioquímicaRenata BarrosoAinda não há avaliações
- Lista de Exercicios (Sistema Tampao e Protein As)Documento10 páginasLista de Exercicios (Sistema Tampao e Protein As)Viviane Costa100% (1)
- Estudo Dirigido 02 - Aminoácidos, Peptídeos e ProteínasDocumento2 páginasEstudo Dirigido 02 - Aminoácidos, Peptídeos e ProteínasDaniel MarquesAinda não há avaliações
- Farmacognosia - SaponinasDocumento13 páginasFarmacognosia - SaponinasKelly Belini100% (1)
- GDEnzimas 01Documento3 páginasGDEnzimas 01Vanessa GonçalvesAinda não há avaliações
- Folha de Exercícios para Prova FinalDocumento11 páginasFolha de Exercícios para Prova FinalAlandersonJosuéVieiraDosReisAinda não há avaliações
- Lista Exercícios - Carboidratos e LipídeosDocumento10 páginasLista Exercícios - Carboidratos e LipídeosGuilherme Belak SchmitkeAinda não há avaliações
- Resumo BioquA - Mica II - P2Documento21 páginasResumo BioquA - Mica II - P2Caroline Carvalho LimaAinda não há avaliações
- Lista 2 Tal 406Documento3 páginasLista 2 Tal 406RicardoCardosoAinda não há avaliações
- Capítulo 6Documento7 páginasCapítulo 6Vânia FerreiraAinda não há avaliações
- Treonina SuinosDocumento16 páginasTreonina SuinostaquarenseAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Carta de Controle - Média e Desvio Padrão Ana Carolina AraújoDocumento7 páginasCarta de Controle - Média e Desvio Padrão Ana Carolina AraújoAna Carolina AráujoAinda não há avaliações
- Carta de Controle I-MR Ana Carolina Araújo Dos SantosDocumento5 páginasCarta de Controle I-MR Ana Carolina Araújo Dos SantosAna Carolina AráujoAinda não há avaliações
- Relatório BioquímicaDocumento2 páginasRelatório BioquímicaAna Carolina Aráujo100% (2)
- Decreto Aguardente de FrutasDocumento47 páginasDecreto Aguardente de FrutasAna Carolina AráujoAinda não há avaliações
- Aula 2 Proteina BrutaDocumento9 páginasAula 2 Proteina BrutaElisangela Bertonha HernandesAinda não há avaliações
- Alimentos Alimentação: AnimalDocumento166 páginasAlimentos Alimentação: AnimalJuliana DuarteAinda não há avaliações
- Qui Caderno4Documento40 páginasQui Caderno4Robson Salviano100% (1)
- Bebida Láctea FermentadaDocumento20 páginasBebida Láctea FermentadaValériaBarbosaGomesAinda não há avaliações
- PrótidosDocumento12 páginasPrótidosBárbaraFrança100% (1)
- Acta Ped Vol 38 N 3 CR Consenso Tratamento Nutricional Leucinose PDFDocumento9 páginasActa Ped Vol 38 N 3 CR Consenso Tratamento Nutricional Leucinose PDFVictoria CabralAinda não há avaliações
- Módulo Química Dos Alimentos 2Documento22 páginasMódulo Química Dos Alimentos 2Laiana De Jesus Sao RicardoAinda não há avaliações
- RelatorioDocumento3 páginasRelatorioEmilly YasminAinda não há avaliações
- Bioquimica L4Documento2 páginasBioquimica L4Lucas CortezeAinda não há avaliações
- Aula 3 - Pratica Curva de Titulacao Da Glicina PDFDocumento2 páginasAula 3 - Pratica Curva de Titulacao Da Glicina PDFAdriana Maria MeneghettiAinda não há avaliações
- AULA 10 - Catabolismo de AminoácidosDocumento8 páginasAULA 10 - Catabolismo de AminoácidosMarcela Lima de BritoAinda não há avaliações
- Art1 NutricaoDocumento8 páginasArt1 NutricaoValéria CruzAinda não há avaliações
- Bioquímica VeterináriaDocumento6 páginasBioquímica VeterináriaCanil Rina Suri AmaryllisAinda não há avaliações
- Bioquimica 1Documento2 páginasBioquimica 1Felipe HiroAinda não há avaliações
- Biomoléculas 3Documento35 páginasBiomoléculas 3VladyslavAinda não há avaliações
- t4 ExerciciosDocumento2 páginast4 Exerciciosfelipe_catenAinda não há avaliações
- Acido Guanidinoacetico PDFDocumento47 páginasAcido Guanidinoacetico PDFladirAinda não há avaliações
- Enade ZootecniaDocumento18 páginasEnade ZootecniaRicardo DutraAinda não há avaliações
- Questionário TP1 - Reação de MaillardDocumento3 páginasQuestionário TP1 - Reação de MaillardIvo LindimAinda não há avaliações
- Orç. Edeia MedicamentosDocumento4 páginasOrç. Edeia MedicamentosMateus Gomes rocha LimaAinda não há avaliações
- CabeloDocumento10 páginasCabeloGeicy Oliveira100% (1)
- (5BIUO) - Aula05 - Aminoácidos Peptídeos e ProteínasDocumento25 páginas(5BIUO) - Aula05 - Aminoácidos Peptídeos e ProteínasAna CristinaAinda não há avaliações
- Biossintese de AminoacidosDocumento13 páginasBiossintese de AminoacidosJuliane Ketlei0% (1)
- Determinação Qualitativa E Quantitativa de Glúten em Farinha de Trigo, Aveia E ArrozDocumento45 páginasDeterminação Qualitativa E Quantitativa de Glúten em Farinha de Trigo, Aveia E ArrozLivia CaleraAinda não há avaliações
- Estudo Fisico Quimico Das ProteinasDocumento15 páginasEstudo Fisico Quimico Das Proteinasvailson GarciaAinda não há avaliações
- Informativo SaúdeDocumento13 páginasInformativo SaúdeVeronikaá BarbianAinda não há avaliações
- Radiofrequencia EffectDocumento56 páginasRadiofrequencia EffectFranciele FonsecaAinda não há avaliações