Escolar Documentos
Profissional Documentos
Cultura Documentos
Soluções Não-Ideais
Enviado por
Davi Alex Nogueira0 notas0% acharam este documento útil (0 voto)
43 visualizações3 páginasO documento discute a Lei de Raoult para soluções não-ideais, explicando que desvios positivos ocorrem quando a pressão de vapor é maior do que o previsto, formando azeótropos positivos, enquanto desvios negativos ocorrem quando a pressão de vapor é menor, formando azeótropos negativos. A lei se aplica apenas a soluções ideais, mas é útil para entender soluções reais, nas quais há interações intermoleculares.
Descrição original:
Resolução exercício físico química
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoO documento discute a Lei de Raoult para soluções não-ideais, explicando que desvios positivos ocorrem quando a pressão de vapor é maior do que o previsto, formando azeótropos positivos, enquanto desvios negativos ocorrem quando a pressão de vapor é menor, formando azeótropos negativos. A lei se aplica apenas a soluções ideais, mas é útil para entender soluções reais, nas quais há interações intermoleculares.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
43 visualizações3 páginasSoluções Não-Ideais
Enviado por
Davi Alex NogueiraO documento discute a Lei de Raoult para soluções não-ideais, explicando que desvios positivos ocorrem quando a pressão de vapor é maior do que o previsto, formando azeótropos positivos, enquanto desvios negativos ocorrem quando a pressão de vapor é menor, formando azeótropos negativos. A lei se aplica apenas a soluções ideais, mas é útil para entender soluções reais, nas quais há interações intermoleculares.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Davi Alex Nogueira - RA: 769277 - Físico Química 2
Soluções Não-Ideais (Reais)
Em 1887, o químico francês François-Marie Raoult propôs o que ficou conhecido
como a Lei de Raoult, que serve para entendermos o comportamento da pressão de vapor
de uma solução formada por duas substâncias que não se misturam (imiscíveis),
baseando-se na pressão parcial de cada composto presente nesta mistura.
Partindo do pressuposto de que as duas substâncias envolvidas se comportam de
maneira ideal. Essa lei baseia-se na ideia de que forças intermoleculares entre diferentes
substâncias são iguais às de moléculas semelhantes.
Ela relaciona a pressão de vapor de uma determinada solução com um determinado
soluto não volátil, que é dada pela pressão de vapor do soluto puro multiplicado pela sua
fração molar, isso irá fornecer a pressão parcial de vapor do componente em questão na
mistura.
As soluções estudadas com essa lei são aquelas com comportamento real, uma vez
que a interação entre suas moléculas são pequenas e permitem que as mesmas
propriedades sejam assumidas como verdade.
Como as soluções ideias praticamente são inexistentes, dois coeficientes são
incorporados nos cálculos que representam interações intermoleculares, sendo eles os
desvios positivos e os desvios negativos.
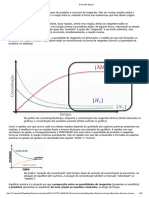
Desvios positivos da lei de Raoult ocorrem quando a pressão de vapor da solução é
maior do que o calculado com a lei de Raoult, isso acontece quando as forças de coesão
entre as moléculas são maiores que as mesmas forças entre moléculas diferentes. Esse
desvio é visto na curva de pressão de vapor como um ponto máximo em uma composição
específica, formando um azeótropo (mistura líquida de dois ou mais compostos químicos
que se comporta como se fosse formado por um único componente e evapora sem alterar
sua composição) positivo.
Desvios negativos da lei de Raoult ocorrem quando a pressão de vapor da mistura é
menor do que o esperado após o cálculo com a lei. Esses desvios aparecem quando as
forças de coesão entre as moléculas na mistura são maiores que as forças médias entre as
partículas dos líquidos em seu estado puro.
Esse tipo de desvio gera uma retenção de cada componente em seu estado líquido
por forças atrativas maiores que as da substância em seu estado puro, de modo que a
pressão parcial de vapor do sistema é reduzida. Os azeótropos negativos nas curvas de
pressão de vapor representam um ponto mínimo e demonstram uma afinidade entre os dois
ou mais componentes envolvidos na mistura.
Essa lei foi muito importânte para entendermos o comportamento das soluções,
porém se encaixam apenas em soluções ideais, que como citado, são quase inexistentes.
Mas então por que estudar as soluções ideias? É justamente para entendermos o
comportamento das maiorias das soluções, às reais, que também são conhecidas como
não-ideais. O estudo das soluções reais é feito tomando-se as soluções ideais como
sistemas de referência.
Numa solução real com desvio positivo temos que a diminuição de energia de Gibbs
que sempre acompanha a formação de uma solução não é tão grande como numa solução
ideal - o processo é menos espontâneo. O contrário verifica-se, evidentemente, na
formação de uma solução real com desvio negativo, o processo é mais espontâneo que a
formação de uma solução ideal.
Dá-se o nome de grandeza de excesso de uma solução real à diferença (positiva ou
negativa) entre o valor de uma propriedade termodinâmica da solução real e o valor da
mesma propriedade da solução ideal correspondente.
Todas as funções de excesso são dependentes do logaritmo do coeficiente de
atividade, que pode ser maior ou menor que a unidade, conforme o desvio da solução real
em relação à solução ideal for positivo ou negativo. A energia de Gibbs de excesso, a
entalpia de excesso, a entropia de excesso e o volume de excesso, guardam entre si
relações análogas às que existem entre as grandezas de mistura correspondentes.
Em uma solução ideal, a variação de entapia e a variação de volumé é zero, de
modo que as funções de excesso da entalpia e do volume representam a entalpia de
mistura e o volume de mistura numa solução real.
REFERÊNCIAS
PILLA, L. Físico-Química 2 - Equilíbrio entre fases, soluções líquidas e eletroquímica.
Editora UFRGS, 2º edição. Porto Alegre-RS, 2010.
MOORE, W. J. Físico-Química, Editora Bluncher LTDA, 4º edição. New Jersey-EUA, 2015.
Misturas não ideais de líquidos.
Disponivel em: https://chemguide.co.uk/physical/phaseeqia/nonideal.html#top
Lei de Raoult: o que é, desvios positivos e negativos. Disponível em:
https://maestrovirtuale.com/lei-de-raoult-o-que-e-desvios-positivos-e-negativos/
Você também pode gostar
- Antes Dos Tempos ConhecidosDocumento442 páginasAntes Dos Tempos Conhecidosrogonpou100% (4)
- As leis ponderais e a consolidação da Química como ciênciaDocumento20 páginasAs leis ponderais e a consolidação da Química como ciênciaWládia LemosAinda não há avaliações
- Geologia básica para engenheiros: uma introdução concisaDocumento269 páginasGeologia básica para engenheiros: uma introdução concisaAndré Spinoza De Castro100% (1)
- Melhores Praticas - YouTubeDocumento32 páginasMelhores Praticas - YouTubeDavi Alex NogueiraAinda não há avaliações
- Equilíbrio Químico: Fatores que Influenciam o DeslocamentoDocumento3 páginasEquilíbrio Químico: Fatores que Influenciam o DeslocamentoMatilde SaraAinda não há avaliações
- Equilíbrio Químico: Propriedades e Fatores que InfluenciamDocumento4 páginasEquilíbrio Químico: Propriedades e Fatores que Influenciamantonio josé das chagas100% (1)
- 1-Conceitos Fundamentais de QuimicaDocumento68 páginas1-Conceitos Fundamentais de QuimicaPedro J. AraújoAinda não há avaliações
- Relatório - Equilibrio QuimicoDocumento11 páginasRelatório - Equilibrio QuimicogcschaunAinda não há avaliações
- Reações químicas: leis ponderais e volumétricasDocumento2 páginasReações químicas: leis ponderais e volumétricasJanaina LeitinhoAinda não há avaliações
- Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e OsmoseDocumento33 páginasPropriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e OsmoseEugenio ManuelAinda não há avaliações
- Voyagers Vol. I IIDocumento98 páginasVoyagers Vol. I IICuradora 6490% (10)
- Síntese Do Sulfato de TetraminocobreDocumento15 páginasSíntese Do Sulfato de TetraminocobreHenriques GuilaAinda não há avaliações
- Propriedades de soluções e efeito de misturaDocumento2 páginasPropriedades de soluções e efeito de misturaBárbara Azevedo TamburiAinda não há avaliações
- Revisão Termodinâmica Fases EquilíbrioDocumento6 páginasRevisão Termodinâmica Fases EquilíbriomarianapeixAinda não há avaliações
- Congelamento 40Documento5 páginasCongelamento 40JamesCRBAinda não há avaliações
- Pressão de VaporDocumento20 páginasPressão de VaporPro Samantha SahleAinda não há avaliações
- FSC QMC 7Documento12 páginasFSC QMC 7Luísa De Melo ArrudaAinda não há avaliações
- Reacções Analíticas PDFDocumento83 páginasReacções Analíticas PDFCaltonAinda não há avaliações
- Aplicações Soluções IdeaisDocumento5 páginasAplicações Soluções IdeaisJoão SegattoAinda não há avaliações
- Equilíbrio Químico: Reações Reversíveis e Fatores que Alteram o SistemaDocumento6 páginasEquilíbrio Químico: Reações Reversíveis e Fatores que Alteram o SistemaEduarda SantannaAinda não há avaliações
- Aula 9 - FQ - Resumo para Avaliação Tira DúvidasDocumento9 páginasAula 9 - FQ - Resumo para Avaliação Tira DúvidasJ. Messias BrittoAinda não há avaliações
- Aula 2 - Solução IdealDocumento12 páginasAula 2 - Solução IdealKiamanda OliveiraAinda não há avaliações
- ODocumento2 páginasOLany MesquitaAinda não há avaliações
- S MDocumento32 páginasS Mnicolashenrique1190Ainda não há avaliações
- Carlameireles-A Descrição Termodinâmica Das Misturas AULA 2Documento27 páginasCarlameireles-A Descrição Termodinâmica Das Misturas AULA 2Thays AlvesAinda não há avaliações
- Tabelad de Reações QuimicasDocumento34 páginasTabelad de Reações QuimicasAlessandra CostaAinda não há avaliações
- Propriedades de equilíbrio de misturas líquidasDocumento23 páginasPropriedades de equilíbrio de misturas líquidasjuvieiraciriloAinda não há avaliações
- Av Fisico-QuimicaDocumento5 páginasAv Fisico-Quimicaweshenrik98Ainda não há avaliações
- Qui MicaDocumento2 páginasQui MicaIsla Leslley Vieira de MoraisAinda não há avaliações
- Resumos - Quimica - 11º - Novo - Programa - 2016Documento10 páginasResumos - Quimica - 11º - Novo - Programa - 2016Margarida FonsecaAinda não há avaliações
- Destilaçao PDFDocumento16 páginasDestilaçao PDFEtiândra SantosAinda não há avaliações
- Introdução à Termodinâmica de MisturasDocumento32 páginasIntrodução à Termodinâmica de MisturasSandro PizzoAinda não há avaliações
- Jaime Choga Ureca Farmacia Pos LaboralDocumento32 páginasJaime Choga Ureca Farmacia Pos LaboralJaime ChogaAinda não há avaliações
- Equilíbrio químico: reações reversíveis e constante KcDocumento10 páginasEquilíbrio químico: reações reversíveis e constante KcAbreu Ngongo Filipa KasanjiAinda não há avaliações
- Apostila 5 - Equilíbrio QuímicoDocumento39 páginasApostila 5 - Equilíbrio QuímicoGustavo MarinhoAinda não há avaliações
- Equilíbrio Químico e Cálculos EstequiométricosDocumento8 páginasEquilíbrio Químico e Cálculos EstequiométricosMariassAinda não há avaliações
- Pressão de Vapor (Lei de Raoult)Documento15 páginasPressão de Vapor (Lei de Raoult)João Ricardo Nunes100% (2)
- Cópia de DesafioDocumento3 páginasCópia de DesafioLeticia IolandaAinda não há avaliações
- Técn Elet Aut ComanDocumento12 páginasTécn Elet Aut ComanxenofontAinda não há avaliações
- Equilíbrio QuímicoDocumento10 páginasEquilíbrio QuímicoYasmim Silva100% (1)
- Relatório Do Experimento 7 - INLAB de QGDocumento11 páginasRelatório Do Experimento 7 - INLAB de QGmarianne carvalhoAinda não há avaliações
- SOLUBILIDADEDocumento11 páginasSOLUBILIDADEVitória FreitasAinda não há avaliações
- Aula 11 - Notas de AulaDocumento17 páginasAula 11 - Notas de AulaDanielAinda não há avaliações
- Reações Quimicas Com GabaritoDocumento35 páginasReações Quimicas Com GabaritoAlessandra CostaAinda não há avaliações
- Quimica 11Documento22 páginasQuimica 11Diana LopesAinda não há avaliações
- QMC AP Equilíbrio Químico Deslocamento de EquilíbrioDocumento11 páginasQMC AP Equilíbrio Químico Deslocamento de EquilíbrioGabriel Lima PizanoAinda não há avaliações
- Propriedades Coligativas I: QuímicaDocumento21 páginasPropriedades Coligativas I: Químicapatricia primonAinda não há avaliações
- Cromato e DicromatoDocumento9 páginasCromato e DicromatoWolney PiresAinda não há avaliações
- Equilíbrio Químico e Lei de Le ChatelierDocumento12 páginasEquilíbrio Químico e Lei de Le ChatelierNicoly MoretoAinda não há avaliações
- Distribuição de Solventes em Solutos Não VoláteisDocumento60 páginasDistribuição de Solventes em Solutos Não VoláteisHenrique FernandesAinda não há avaliações
- Trabalho Quimica 6grupo - 1Documento26 páginasTrabalho Quimica 6grupo - 1Jaime ChogaAinda não há avaliações
- Equações de conservação em escoamentos compressíveis e incompressíveisDocumento15 páginasEquações de conservação em escoamentos compressíveis e incompressíveisMilton ChiluvaneAinda não há avaliações
- Propriedades Coligativas em SoluçõesDocumento2 páginasPropriedades Coligativas em SoluçõesMaria SouzaAinda não há avaliações
- Hlio RsmoDocumento6 páginasHlio RsmoLinda SemedoAinda não há avaliações
- Equilibrio QuimicoDocumento20 páginasEquilibrio QuimicoGiulliano Carlos ThomazAinda não há avaliações
- Equilíbrio químico e deslocamento do estado de equilíbrioDocumento6 páginasEquilíbrio químico e deslocamento do estado de equilíbrioKauã RenatoAinda não há avaliações
- Solução ideal e leis de Raoult e HenryDocumento14 páginasSolução ideal e leis de Raoult e HenrytthaliaramosAinda não há avaliações
- Leis PonderaisDocumento3 páginasLeis PonderaisLorena GomesAinda não há avaliações
- Reações Químicas e EstequiometriaDocumento20 páginasReações Químicas e Estequiometrialaiane rabelo bragaAinda não há avaliações
- Apostila de Físico-Quimica e Corrosão AlteradoDocumento26 páginasApostila de Físico-Quimica e Corrosão Alteradorogerio cardoso dos santosAinda não há avaliações
- Equilíbrio Químico - 3° AnoDocumento17 páginasEquilíbrio Químico - 3° AnoJeyciane RosaAinda não há avaliações
- Equilíbrios Químicos HomogêneosDocumento19 páginasEquilíbrios Químicos HomogêneosDarllan R. BarrosAinda não há avaliações
- Gilmenebianco AzeótropoDocumento8 páginasGilmenebianco Azeótropomikey12345452863879Ainda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Agency To Client Presentation - PT BRDocumento14 páginasAgency To Client Presentation - PT BRDavi Alex NogueiraAinda não há avaliações
- Introdução A Quimica OrganicaDocumento64 páginasIntrodução A Quimica OrganicaDavi Alex Nogueira100% (1)
- Introdução A Quimica OrganicaDocumento64 páginasIntrodução A Quimica OrganicaDavi Alex NogueiraAinda não há avaliações
- Stories Playbook - PT-BRDocumento2 páginasStories Playbook - PT-BRDavi Alex NogueiraAinda não há avaliações
- Síntese e purificação da acetanilidaDocumento10 páginasSíntese e purificação da acetanilidaDavi Alex NogueiraAinda não há avaliações
- Relatório 1 - Química Orgânica 2Documento14 páginasRelatório 1 - Química Orgânica 2Davi Alex NogueiraAinda não há avaliações
- Exemplo 7Documento1 páginaExemplo 7Davi Alex NogueiraAinda não há avaliações
- Síntese e purificação da acetanilidaDocumento10 páginasSíntese e purificação da acetanilidaDavi Alex NogueiraAinda não há avaliações
- Síntese e purificação da acetanilidaDocumento10 páginasSíntese e purificação da acetanilidaDavi Alex NogueiraAinda não há avaliações
- Exemplo 7Documento1 páginaExemplo 7Davi Alex NogueiraAinda não há avaliações
- Exemplo 8Documento1 páginaExemplo 8Davi Alex NogueiraAinda não há avaliações
- O que é o Universo? Origem e elementosDocumento3 páginasO que é o Universo? Origem e elementospink1967Ainda não há avaliações
- Escalas de temperaturaDocumento26 páginasEscalas de temperaturaThiago ArtiolliAinda não há avaliações
- PT 2 Cap 17 Relacoes Moleculares Ki e KRDocumento4 páginasPT 2 Cap 17 Relacoes Moleculares Ki e KRAlan RobertoAinda não há avaliações
- Apostila - MASSADocumento26 páginasApostila - MASSALaís Alexandre0% (1)
- 04 CapacitoresDocumento4 páginas04 Capacitoresapi-371309667% (3)
- Processos Físicos de PolpaçãoDocumento10 páginasProcessos Físicos de PolpaçãoRuth-DavidMothéAinda não há avaliações
- Prova Final Avaliação - Março 2018Documento7 páginasProva Final Avaliação - Março 2018Adriana BemstarAinda não há avaliações
- Ontologias possíveis em Bruno Latour e a desconstrução do paradigma ocidental natureza/culturaDocumento3 páginasOntologias possíveis em Bruno Latour e a desconstrução do paradigma ocidental natureza/culturaFrancisco Savoi de AraújoAinda não há avaliações
- Teste Ecologia - 2 BimDocumento2 páginasTeste Ecologia - 2 BimRafael FariaAinda não há avaliações
- 3.2 Agregado GraúdoDocumento38 páginas3.2 Agregado GraúdoLETICIA DAS GRACAS ANTONIO SILVAAinda não há avaliações
- Fisica Moderna CadernoDocumento109 páginasFisica Moderna CadernoMIQUEIAS CARNEIROAinda não há avaliações
- O que são válvulas de segurança e válvulas de alívioDocumento4 páginasO que são válvulas de segurança e válvulas de alívioEvando Pereira dos SantosAinda não há avaliações
- Momento Linear e Colisoes - GABARITODocumento53 páginasMomento Linear e Colisoes - GABARITOMayara FigueiredoAinda não há avaliações
- Permacultura 4 CARD 02 1Documento1 páginaPermacultura 4 CARD 02 1Fernanda F. Alves PelegriniAinda não há avaliações
- Apostila Conforto UFRJ PDFDocumento84 páginasApostila Conforto UFRJ PDFpauloamancioferroAinda não há avaliações
- Exercícios gases ideaisDocumento11 páginasExercícios gases ideaisalineceliaAinda não há avaliações
- Subestação Aérea 225kva PNT Ind e Com de Plasticos Ltda.Documento6 páginasSubestação Aérea 225kva PNT Ind e Com de Plasticos Ltda.Robson CordeiroAinda não há avaliações
- Convecção de MassaDocumento2 páginasConvecção de MassaJordão RodriguesAinda não há avaliações
- Leis Da TermodinâmicaDocumento3 páginasLeis Da Termodinâmicaweslleyv003Ainda não há avaliações
- ColourFutures2022 2Documento75 páginasColourFutures2022 2Janaiana UchoaAinda não há avaliações
- Exercícios de EstequiometriaDocumento1 páginaExercícios de EstequiometrianayaracoriolanoAinda não há avaliações
- 3 - Cadeias Alimentares e Teias TróficasDocumento2 páginas3 - Cadeias Alimentares e Teias TróficasMaria OliveiraAinda não há avaliações
- Prova Mestrado IQ Unicamp 2011-2sDocumento7 páginasProva Mestrado IQ Unicamp 2011-2srennan_ps49950% (2)
- Resumo do livro Evolução – O sentido da BiologiaDocumento7 páginasResumo do livro Evolução – O sentido da BiologiaVictor TurchettoAinda não há avaliações
- Lista de preços de materiais e equipamentos fotovoltaicosDocumento95 páginasLista de preços de materiais e equipamentos fotovoltaicosBruno HugolineAinda não há avaliações
- SubsistemasDocumento2 páginasSubsistemasmafraitoAinda não há avaliações