Escolar Documentos
Profissional Documentos
Cultura Documentos
Princípios da destilação: pontos de ebulição e tipos
Enviado por
Kamily SoaresDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Princípios da destilação: pontos de ebulição e tipos
Enviado por
Kamily SoaresDireitos autorais:
Formatos disponíveis
PRINCÍPIOS DA DESTILAÇÃO
Introdução:
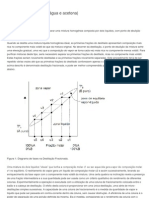
As moléculas de um líquido tendem a escapar da superfície, tornando-se
gasosas, mesmo a temperaturas inferiores ao ponto de ebulição. Quando o líquido é
colocado em um recipiente fechado, a pressão exercida pelas moléculas na fase gasosa
sobe até atingir o equilíbrio, a uma determinada temperatura. Esta pressão de equilíbrio
é conhecida como pressão de vapor e é uma constante característica do material para
uma dada temperatura. Usualmente a pressão de vapor é expressa em termos da altura
de uma coluna de mercúrio que produz uma pressão equivalente.
Quando um líquido é aquecido, sua pressão de vapor aumenta até atingir o ponto
onde se iguala à pressão externa. Quando atinge este ponto de equilíbrio o líquido entra
em ebulição. Este fenômeno é importante como método de caracterizar uma amostra
líquida (ponto de ebulição) e/ou como técnica de purificação de misturas (destilação).
Chama-se ponto de ebulição a temperatura na qual a pressão do vapor se iguala à
pressão atmosférica. O ponto de ebulição é uma das propriedades físicas dos líquidos. O
ponto de ebulição normal é a temperatura na qual um líquido entra em ebulição à
pressão de 760 mmHg (1 atm).
A destilação é o método mais usado para purificar líquidos, sendo muito
utilizada para separar líquidos com temperaturas de ebulição diferentes. O processo de
destilação envolve a evaporação de um líquido e a sua subseqüente condensação. A
evaporação é conseguida por aquecimento da mistura, durante a separação o vapor é
rico no componente de menor ponto de ebulição. A temperatura se mantém constante
durante a destilação do componente mais volátil. O mesmo comportamento é observado
com misturas contendo um líquido e uma impureza não volátil, uma vez que o material
condensado não está contaminado pela impureza. Numa mistura, a separação é tanto
mais fácil quanto maiores forem as diferenças entre os pontos de ebulição dos diferentes
componentes que a constituem.
DESTILAÇÃO
O processo da destilação consiste no aquecimento de um líquido até seu ponto
de ebulição, onde os vapores são a um dispositivo refrigerado. Nesse ambiente
refrigerado esses vapores são condensados e coletados na forma de líquido. A destilação
é o método mais comum usado na separação e purificação de líquidos, principalmente
quando os componentes da mistura têm pontos de ebulição bem diferentes ou quando
um dos componentes não destila. Em um laboratório de química orgânica, quatro
métodos básicos de destilação são consideravelmente úteis: destilação simples,
destilação a vácuo (destilação à pressão reduzida), destilação fracionada e destilação
com arraste de vapor, destilação azeotrópica.
Tipos de destilação:
Simples: consiste, basicamente, na vaporização de um líquido por aquecimento
seguida da condensação do vapor formado e recolhimento do condensado em um frasco
apropriado. A destilação simples tem a aplicação na separação de líquidos de impurezas
sólidas, na separação dos componentes de uma mistura cujos pontos de ebulição difiram
de mais de 85 ºC, em reações orgânicas para retirada de produtos com baixo ponto de
ebulição. A Figura 3 mostra uma montagem típica de destilação simples com toda a
aparelhagem utilizada. O bulbo do termômetro deve estar posicionado na direção da
saída da cabeça de destilação, determinando assim a temperatura do vapor. O
condensador de tubo reto (Liebig) deverá estar disposto sempre em posição inclinada,
de maneira que a água fria entre pela sua lateral inferior, sendo expelida pela abertura
lateral superior Se for feito o inverso, entrar com a água por cima, o condensador ficará
com um bolsão de ar, o que prejudicará a eficiência na condensação, outra razão é que a
extremidade do condensador próximo à entrada do vapor é muito mais quente sendo
assim a região onde ocorrerá maior aquecimento da água, e a eficiência da condensação
é melhor quando a temperatura na saída do condensador é o mais baixo possível.
Figura 3. Aparelhagem para uma destilação simples.
Destilação Fracionada: numa destilação fracionada ocorrem sucessivamente
várias destilações simples, embora não sejam independentes umas das outras. Para
realizar a destilação fracionada, recorre-se às chamadas colunas de fracionamento que
se colocam entre o balão de destilação e o condensador, estas colunas diferem em
tamanho, tipo de material e preenchimento. As colunas de fracionamento mais comuns
são as do tipo Vigreux e Hempel. A primeira é um tubo de vidro com várias
reentrâncias em forma de dentes, distribuídas de modo que as pontas de um par de
dentes quase se toquem. A coluna do tipo Hempel é formada por um tubo de vidro
empacotado com pequenas bolas ou anéis de vidro, entre outros.
A coluna de fracionamento é um dispositivo utilizado para aumentar a eficiência
deste processo de redestilação. Consiste em uma coluna vertical empacotada com algum
material inerte, tal como grânulos de vidro ou fornecida com algum outro dispositivo
(dentes internos) aumentando a superfície onde o vapor pode se condensar. Como os
vapores quentes sobem através da coluna, eles condensam e fluem de volta para baixo
da coluna. O condensado, ao bater nas partes mais baixas, mais quentes da coluna, é
revaporizado e os componentes mais voláteis prosseguem coluna acima uma vez mais.
Se a coluna for eficiente, este processo será repetido muitas vezes e o destilado
consistirá nos componentes com pontos de ebulição mais baixos da mistura na forma
quase pura, logo o objetivo desta coluna é proporcionar em uma única destilação, uma
série de microdestilações simples sucessivas.
Ao aquecer a mistura, o vapor que ascende ao longo da coluna de fracionamento
condensa parcialmente. Enquanto que uma parte do condensado forma uma corrente de
líquido descendente, a outra parte sofre evaporação por absorção de calor do vapor
ascendente. Este ciclo repete-se ao longo de toda a coluna, de modo que a ascensão do
vapor é acompanhada por uma sucessão de condensações que lhe vão retirando o
componente menos volátil. Como conseqüência, quando o vapor atinge o topo da coluna
encontra-se bastante enriquecido no componente mais volátil. Pode dizer-se que foi
estabelecido um contato líquido-vapor em contracorrente (líquido descendente e vapor
ascendente) acompanhado de transferência de massa e de calor.
A destilação fracionada é aplicada na separação de componentes de misturas
cujos pontos de ebulições difiram de menos de 80 ºC.
Na Figura 5 mostra uma montagem típica de destilação fracionada com toda a
aparelhagem utilizada.
Figura 5. Aparelhagem para destilação fracionada.
À pressão reduzida: muitas substâncias orgânicas não podem ser destiladas
satisfatoriamente sob pressão ambiente porque tem ponto de ebulição muito alto (l40-
150oC) ou porque sofrem alteração (decomposição, oxidação, etc.) antes que seu ponto
de ebulição seja atingido. Reduzindo-se a pressão externa, sobre o líquido, para l-30
mmHg, o ponto de ebulição é reduzido consideravelmente de modo que, a destilação
pode ser feita sem perigo de decomposição. Além disso, substâncias de alto ponto de
ebulição podem ser mais facilmente destiladas desta maneira.
Exemplo: O acetoacetato de etila entra em ebulição com decomposição à l80oC
sob pressão de 760 mmHg, e entra em ebulição sem decompor a 78 oC sob pressão de l8
mmHg (estas condições são indicadas usualmente da seguinte maneira: 78 o/l8mm). A
redução da pressão externa sobre o líquido é conseguida adaptando-se ao sistema de
destilação uma bomba de vácuo ou trompa de água.
Para efetuar uma destilação à pressão reduzida, devem-se considerar alguns
aspectos: a pressão necessária para atingir o ponto de ebulição desejado; o tipo de
bomba de vácuo empregado e a aparelhagem apropriada.
Ao realizar a operação de destilação à pressão reduzida, lembre-se de: usar
óculos de proteção; certificar-se de que a aparelhagem não esteja trincada; usar vidraria
com juntas; ligar a bomba sempre com a entrada de ar aberta e só então fechar
lentamente, controlando a pressão; ao desligar a bomba, abrir primeiro a entrada de ar.
Durante a preparação de substâncias orgânicas, é freqüente a necessidade de
eliminar o solvente do meio reacional antes de proceder à purificação do produto obtido
ou mesmo após uma purificação prévia. A remoção de solventes é bastante facilitada
pelo uso de um sistema para destilação a vácuo conhecido como evaporador rotatório
(Figura 6). Este sistema emprega normalmente trompa d’água como fonte de vácuo e
banho-maria para aquecimento. O balão contendo a solução a concentrar, é acoplado à
aparelhagem de destilação através de um tubo de vidro que gira a uma velocidade
controlada pelo motor. Ao ser aplicado o vácuo e, em seguida o aquecimento, o solvente
é evaporado, condensado e recolhido no balão do evaporador rotatório. A aparelhagem
permite a evaporação rápida da maior parte dos solventes devido à grande área
superficial de líquido formada com a rotação do balão.
Figura 6. Evaporador rotatório ou rotavapor
Você também pode gostar
- Relatorio 03 ExperiementalDocumento17 páginasRelatorio 03 ExperiementalelenitabastosAinda não há avaliações
- Pratica Destilação Do VinhoDocumento5 páginasPratica Destilação Do Vinhoelizael01020305Ainda não há avaliações
- QUI 139 - Experimento 4 - DESTILAÇÃODocumento14 páginasQUI 139 - Experimento 4 - DESTILAÇÃOVinícius HAinda não há avaliações
- Destilação Simples É Um Processo Que Permite A Separação de Um Líquido de Uma Substância Não VolátilDocumento13 páginasDestilação Simples É Um Processo Que Permite A Separação de Um Líquido de Uma Substância Não VolátilValsergio BarrosAinda não há avaliações
- Destilação fracionada e simples: processos e aplicaçõesDocumento2 páginasDestilação fracionada e simples: processos e aplicaçõeslucasbaroAinda não há avaliações
- DESTILAÇÃODocumento3 páginasDESTILAÇÃOJosé Assis Gomes de BritoAinda não há avaliações
- Destilação do vinho para obtenção de álcoolDocumento8 páginasDestilação do vinho para obtenção de álcoolmauricelioaraujoAinda não há avaliações
- EXPERIMENTO 2 - DESTILACAO e DENSIDADEDocumento14 páginasEXPERIMENTO 2 - DESTILACAO e DENSIDADEDebora FontesAinda não há avaliações
- DESTILAÇÃO1Documento10 páginasDESTILAÇÃO1Roberta BelazAinda não há avaliações
- Evaporação de SoluçõesDocumento17 páginasEvaporação de SoluçõesThiago LuchetaAinda não há avaliações
- Relatório DestilaçãoDocumento8 páginasRelatório DestilaçãoJoão Pedro Alves RodriguesAinda não há avaliações
- Em QuímicaDocumento5 páginasEm QuímicaPamela BarbosaAinda não há avaliações
- Aula7 - Colunas de DestilaçaoDocumento20 páginasAula7 - Colunas de DestilaçaoDaniel ZimermannAinda não há avaliações
- 5-Solucoes e SeparacaoDocumento6 páginas5-Solucoes e SeparacaoAdriano FuriniAinda não há avaliações
- Destilação: principais tipos e aplicaçõesDocumento47 páginasDestilação: principais tipos e aplicaçõesMichael Lima100% (1)
- EvaporaçãoDocumento53 páginasEvaporaçãoviniciuskanxa53Ainda não há avaliações
- DestilaçãoDocumento5 páginasDestilaçãoBruno SouzaAinda não há avaliações
- Temperatura de SaturaçãoDocumento4 páginasTemperatura de SaturaçãothiagoclageAinda não há avaliações
- Curso DestilaçãoDocumento118 páginasCurso DestilaçãoLino Cleber GregorioAinda não há avaliações
- DQ321 Relatório experimentos destilaçãoDocumento11 páginasDQ321 Relatório experimentos destilaçãoMaisa Amaral100% (1)
- BPL RELATORIODocumento16 páginasBPL RELATORIOPatricia SallesAinda não há avaliações
- N° 03 - DestilaçãoDocumento18 páginasN° 03 - DestilaçãoCarol FariasAinda não há avaliações
- Relatório de Química 12º - Destilação SimplesDocumento5 páginasRelatório de Química 12º - Destilação SimplesLinteloth0% (1)
- Destilação Fracionada PDFDocumento6 páginasDestilação Fracionada PDFJohann Costa CastelliAinda não há avaliações
- Destilação FracionadaDocumento6 páginasDestilação Fracionadavinicius nascimentoAinda não há avaliações
- Operações de destilação: métodos e cálculosDocumento7 páginasOperações de destilação: métodos e cálculosTalles CaioAinda não há avaliações
- Fatores EvaporaçãoDocumento18 páginasFatores EvaporaçãoPatrícia CoelhoAinda não há avaliações
- Operações Unitárias 3: Destilação e suas aplicaçõesDocumento10 páginasOperações Unitárias 3: Destilação e suas aplicaçõesanabeneAinda não há avaliações
- Destilação: Processo de Separação por Equilíbrio Líquido-VaporDocumento118 páginasDestilação: Processo de Separação por Equilíbrio Líquido-VaporFabricio Ilidio DiasAinda não há avaliações
- Destilação: separação de líquidosDocumento6 páginasDestilação: separação de líquidosMartinõ MarcellAinda não há avaliações
- Apresentação - OperaçõesUnitáriaspartell - Aula 13-10-23Documento111 páginasApresentação - OperaçõesUnitáriaspartell - Aula 13-10-23ing.fatimaferreiragomezAinda não há avaliações
- Processo de Destilação FracionadaDocumento4 páginasProcesso de Destilação Fracionadaglaucia machadoAinda não há avaliações
- 10344804042012quimica Organica Experimental Aula 5Documento23 páginas10344804042012quimica Organica Experimental Aula 5Artur Pereira NetoAinda não há avaliações
- REFRIGERAÇÃO Tos de Refrigeração Objetos Desse CursoDocumento10 páginasREFRIGERAÇÃO Tos de Refrigeração Objetos Desse CursoAntonioMoraesAinda não há avaliações
- O ciclo básico de refrigeraçãoDocumento11 páginasO ciclo básico de refrigeraçãoAntonioMoraesAinda não há avaliações
- Trabalho de QuímicaDocumento24 páginasTrabalho de QuímicaKaillany de SouzaAinda não há avaliações
- Experimento de Destilação DiferencialDocumento13 páginasExperimento de Destilação DiferencialL#renaAinda não há avaliações
- Destilacao Ponto de EbulicaoDocumento11 páginasDestilacao Ponto de EbulicaojorgearbAinda não há avaliações
- Evaporação e CristalizaçãoDocumento8 páginasEvaporação e CristalizaçãoAbsolon CarvalhoAinda não há avaliações
- Curso Ar CondicionadoDocumento56 páginasCurso Ar CondicionadonrimfAinda não há avaliações
- Extração Líquido - LíquidoDocumento2 páginasExtração Líquido - LíquidoJosé Assis Gomes de BritoAinda não há avaliações
- Destilação Simples e FracionadaDocumento2 páginasDestilação Simples e FracionadaLucas PontesAinda não há avaliações
- Destilaçao FracionadaDocumento4 páginasDestilaçao FracionadaEfrero RochyAinda não há avaliações
- Relatório de Líquidos - Julia MainiDocumento7 páginasRelatório de Líquidos - Julia Mainijulia.maini99Ainda não há avaliações
- Relatorio Destilação Simples e FracionadaDocumento11 páginasRelatorio Destilação Simples e FracionadaVictor MarquesAinda não há avaliações
- Aula 4Documento2 páginasAula 4Alan Victor Ferreira ModoloAinda não há avaliações
- Destilação Fracionada de Água e AcetonaDocumento5 páginasDestilação Fracionada de Água e AcetonaEdu AntunesAinda não há avaliações
- Destilação Simples - Victor GuedesDocumento6 páginasDestilação Simples - Victor GuedesVictor GuedesAinda não há avaliações
- Bebidas DestiladasDocumento105 páginasBebidas DestiladasPedro SilvaAinda não há avaliações
- Determinação Do Ponto de Ebulição de Um LíquidoDocumento3 páginasDeterminação Do Ponto de Ebulição de Um LíquidoBruno EduardoAinda não há avaliações
- Destilação Fracionada e Destilação Por Arraste de VaporDocumento13 páginasDestilação Fracionada e Destilação Por Arraste de VaporNatáliaCabralAinda não há avaliações
- Operações Unitárias - DestilaçãoDocumento45 páginasOperações Unitárias - DestilaçãoJoãoPedroAinda não há avaliações
- EVAPORAÇÃO - PPTX - 2Documento31 páginasEVAPORAÇÃO - PPTX - 2alcidanAinda não há avaliações
- Destilação fracionada: fundamentos e equipamentosDocumento15 páginasDestilação fracionada: fundamentos e equipamentosnicolleAinda não há avaliações
- EVAPORAÇÃODocumento15 páginasEVAPORAÇÃOMatheus VercosaAinda não há avaliações
- Relatório Quimica Destilação Simples e FracionadaDocumento13 páginasRelatório Quimica Destilação Simples e FracionadaFormatPcs100% (2)
- Resumo Sistemas Termicos Prova 2Documento4 páginasResumo Sistemas Termicos Prova 2Rúbia Cristina FavrettoAinda não há avaliações
- Exp 4 RelatórioDocumento7 páginasExp 4 RelatórioAlice CordeiroAinda não há avaliações
- Modelo de Prova - P2Documento11 páginasModelo de Prova - P2Kamily SoaresAinda não há avaliações
- Lista de Fisica 2Documento4 páginasLista de Fisica 2Kamily SoaresAinda não há avaliações
- Termodinamica e Gases Fisica BasicaDocumento2 páginasTermodinamica e Gases Fisica BasicaKamily SoaresAinda não há avaliações
- Extração de óleos essenciais por hidrodestilaçãoDocumento2 páginasExtração de óleos essenciais por hidrodestilaçãoKamily SoaresAinda não há avaliações
- Destilação de água e etanolDocumento7 páginasDestilação de água e etanolKamily SoaresAinda não há avaliações
- Destilação de água e etanolDocumento7 páginasDestilação de água e etanolKamily SoaresAinda não há avaliações
- Relatório DestilaçãoDocumento9 páginasRelatório DestilaçãoJohny ParmaAinda não há avaliações
- Métodos Separação MisturasDocumento22 páginasMétodos Separação MisturasGisele MedeirosAinda não há avaliações
- Plano de Aula Cie6 03me08Documento6 páginasPlano de Aula Cie6 03me08Marli CorreaAinda não há avaliações
- Material de Apoio - Química - Geral - João VictorDocumento94 páginasMaterial de Apoio - Química - Geral - João Victorgustavoluisf10Ainda não há avaliações
- Destilaçao AcetonaDocumento11 páginasDestilaçao AcetonaElisangela CoelhoAinda não há avaliações
- Marco Antonio FarahDocumento314 páginasMarco Antonio FarahAline Pinheiro100% (1)
- Misturas na vida diáriaDocumento30 páginasMisturas na vida diáriaIvete Siqueira100% (1)
- Apostila de Quã - Mica 9â EtapaDocumento18 páginasApostila de Quã - Mica 9â EtapaRai RodriguesAinda não há avaliações
- Orgânica3 Hidrocarbonetos (Parte1)Documento21 páginasOrgânica3 Hidrocarbonetos (Parte1)Lorenzo RamosAinda não há avaliações
- Destilação Simples e FracionadaDocumento2 páginasDestilação Simples e FracionadaLucas PontesAinda não há avaliações
- Relatório Orgânica - Destilação FracionadaDocumento7 páginasRelatório Orgânica - Destilação FracionadaOliveira Salezio Gabriel100% (1)
- Separação de misturas por destilaçãoDocumento8 páginasSeparação de misturas por destilaçãoVINICIUS VANDER LIMA TOMAINAinda não há avaliações
- 23 20an C3 A1lise 20imediataDocumento22 páginas23 20an C3 A1lise 20imediatasofia santinAinda não há avaliações
- Destilação: separação de líquidosDocumento6 páginasDestilação: separação de líquidosMartinõ MarcellAinda não há avaliações
- Experimento 3 - Destilação FracionadaDocumento11 páginasExperimento 3 - Destilação FracionadaMaria Amélia HawthorneAinda não há avaliações
- Destilação fracionada de álcool e águaDocumento3 páginasDestilação fracionada de álcool e águaMarluce ChiariAinda não há avaliações
- Destilação fracionada: fundamentos e equipamentosDocumento15 páginasDestilação fracionada: fundamentos e equipamentosnicolleAinda não há avaliações
- Aproveitamento e Segurança No LaboratórioDocumento35 páginasAproveitamento e Segurança No LaboratórioLeandro FrenedaAinda não há avaliações
- Recuperação de Etanol Por Destilação Com RefluxoDocumento15 páginasRecuperação de Etanol Por Destilação Com Refluxoclaudia PozzerAinda não há avaliações
- Química - Destilação e separação de misturasDocumento3 páginasQuímica - Destilação e separação de misturasnelsongomes01Ainda não há avaliações
- Destilação de Uma Mistura BináriaDocumento11 páginasDestilação de Uma Mistura BináriaIzabella BarbozaAinda não há avaliações
- Destilação do vinho para obtenção de álcoolDocumento8 páginasDestilação do vinho para obtenção de álcoolmauricelioaraujoAinda não há avaliações
- Equipamentos de separação industrial: destiladores, extratores, absorvedores e adsorvedoresDocumento24 páginasEquipamentos de separação industrial: destiladores, extratores, absorvedores e adsorvedoresAlex VianaAinda não há avaliações
- Processos de separação de misturasDocumento15 páginasProcessos de separação de misturasJoão Victor LimaAinda não há avaliações
- Fontes Naturais de HidrocarbonetoDocumento8 páginasFontes Naturais de HidrocarbonetoCelio Wilson Muianga91% (11)
- Relatório 3Documento3 páginasRelatório 3alex.estudoseqAinda não há avaliações
- Projeto de destilação atmosférica de petróleoDocumento30 páginasProjeto de destilação atmosférica de petróleoGuilherme MedeirosAinda não há avaliações
- Destilação fracionada multicomponente: métodos de Fenske-Underwood-Gilliland-Kirkbride e Wang-HenkeDocumento24 páginasDestilação fracionada multicomponente: métodos de Fenske-Underwood-Gilliland-Kirkbride e Wang-HenkeStefannie SargoAinda não há avaliações
- Operacoesunitarias-PetrobrasDocumento50 páginasOperacoesunitarias-Petrobrasnope tsuAinda não há avaliações
- 1BI EM 1ano QUIMICA - GABDocumento6 páginas1BI EM 1ano QUIMICA - GABMaisa TavaresAinda não há avaliações