Escolar Documentos
Profissional Documentos
Cultura Documentos
Síntese de AAS
Enviado por
Paula FerreiraTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Síntese de AAS
Enviado por
Paula FerreiraDireitos autorais:
Formatos disponíveis
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
Síntese de Ácido Acetilsalicílico (AAS)
Carolina Cavalcanti Duarte1, João Gabriel Oliveira Santos1, Letícia de Lima
Nascimento1 e Liliana da Silva Santos1
1
Laboratório de Química, Unidade Universitária de Farmácia, Centro Setorial de Ciências
Biológicas e da Saúde, Centro Universitário Estadual da Zona Oeste UEZO
Resumo:
Realizou-se reações para a obtenção do ácido acetilsalicílico (AAS) que ocorre pela substituição
nucleofílica na carbonila a partir da adição e eliminação do anidrido acético. O ácido salicílico
sofre uma acetilação quando reage com esse anidrido, em um meio contendo ácido sulfúrico onde
ocorre a catálise ácida. Testes de confirmação foram realizados e apesar da sua solubilidade
ocorrer o ponto de fusão da amostra mostrou ser impura, mesmo tendo a obtenção dos cristais de
ácido acetilsalicílico.
Palavras-chave: ácido salicílico, anidrido acético, ponto de fusão
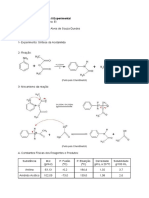
1. Introdução
O ácido acetilsalicílico, conhecido como aspirina® ou AAS, tem como histórico mais de 3.500
anos e até hoje é o medicamento mais conhecido por diferentes países. Ele é pertencente à família
dos salicilatos e tem como função servir para tratar dores, febres e inflamações. Na antiguidade
usava-se as suas folhas secas em infusão para tratamentos de dor. Porém o AAS só foi desenvolvido
mesmo na Alemanha há mais de cem anos por Felix Hoffmann, que era um pesquisador das
indústrias Bayer.
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
Figura 1: fórmula estrutural do ácido acetilsalicílico
Além dos anti-inflamatórios não esteróides (AINE), o ácido acetilsalicílico (AAS) são os
fármacos mais prescritos em todo o mundo (Couto, 2010).
Logo após a comprovação dos seus efeitos anti-inflamatórios, o ASS foi introduzido na
medicina em 1899. A origem de nome Aspirina é representada da seguinte forma: o A vem de acetil;
Spir se refere à Spiraea ulmaria, a planta que fornece o ácido salicílico; e o in era um sufixo na
época. O ácido acetilsalicílico administrado representa um dos fármacos mais consumidos no
mundo e neste ano completou 110 anos de sua descoberta (Maldonado, 2009).
Como a reação da síntese de AAS ocorre por uma substituição nucleofílica na carbonila, o que
acontece é que há o ataque nucleofílico do grupamento hidroxila fenólico sob o carbono carbonílico
do anidrido acético. Logo após ocorre a eliminação do ácido acético e se forma como um
subproduto dessa reação de acetilação. O uso de ácido sulfúrico neste reação se dá pelo aumento da
velocidade da reação de esterificação, ou seja, melhor no ponto de vista industrial. No período de
formação do ácido acetilsalicílico, esta reação tende a formar muitas impurezas. E é por esse motivo
que já existem técnicas para a recristalização desse produto para a purificação do mesmo.
Figura 2: reação geral da acetilação do ácido salicílico
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
2. Objetivo
Este procedimento experimental tem como objetivo a obtenção do ácido acetilsalicílico por uma
reação de acetilação.
3. Materiais e Métodos
3.1. Materiais
Bécher 1000 ml Pera de sucção
Bécher 250 ml Recipiente para banho de gelo
Erlenmeyer 125 ml Pisset
Termômetro Almofariz e pistilo
Bastão de vidro Capilar com uma extremidade selada
Proveta 50 ml Óleo de soja
Barra magnética Suporte universal
Chapa aquecedora com agitador Garra de 3 dedos
magnético Barbante
Espátula de aço inox Gelo
Vidro de relógio Papel para fazer envelope
Balança analítica Fita adesiva para fechar o envelope
Pipeta graduada de 10 ml Ácido salicílico
Papel filtro Anidrido acético
Bomba à vácuo e mangueiras Água destilada gelada
Funil de buchnner Bicarbonato de sódio P.A.
Kitassato Ácido acetilsalicílico sintetizado
3.2. Métodos: Síntese do ácido acetilsalicílico
Foi adicionado 2,07 g de ácido salicílico no vidro de relógio, com auxílio de uma espátula
de aço e balança analítica, que posteriormente, foi transferido para um erlenmeyer de 250 ml.
Neste erlenmeyer foi adicionado 3,3 ml de anidrido acético e a seguir foi colocada 5 gotas de
ácido sulfúrico P.A., com auxílio de pipeta graduada de 10 ml e pera de sucção. O
procedimento foi realizado na capela para a proteção de todos presentes.
Foi feita uma pequena agitação manual do erlenmeyer com a solução até ela tornar-se
límpida. Essa solução foi aquecida em banho-maria num bécher de 1000 ml, por 10 minutos,
numa faixa de temperatura monitorada entre 50°C e 60°C com auxílio de termômetro.
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
Junto ao aquecimento, preparou-se uma solução saturada de NaHCO 3: num bécher de 250
ml contendo 25 ml de água destilada gelada, foi se adicionando NaHCO3 P.A. aos poucos, com
auxílio de espátula de aço inox, até a solução saturar.
Após o término dos 10 minutos de aquecimento, o erlenmeyer foi retirado do banho-maria e
realizou-se fricção contra a parede da vidraria com um bastão de vidro. A utilização do banho de
gelo foi necessária.
Posteriormente, filtrou-se à vácuo os cristais formados em aparelhagem de funil de Buchner.
Os cristais foram acondicionados em envelope de papel para secagem.
4. Resultados e Discussão
4.1. Mecanismo
A síntese do ácido acetil salicílico, comercialmente conhecido como Aspirina, ocorreu por meio de
uma reação entre o ácido salicílico e o anidrido acético usando o ácido sulfúrico como catalizador,
sendo formado também o ácido acético. Em resumo, a reação ocorre através do ataque nucleofílico
do grupo OH fenólico sobre o carbono polarizado do anidrido acético, seguido do ataque ao próton
fornecido pelo ácido sulfúrico, ocorrendo a eliminação de ácido acético, formado como um
subproduto da reação.
Fig
ura 3:
Equação global da síntese da Aspirina.
O mecanismo se dá pela reação do anidrido acético com a hidroxila do ácido salicílico por
catálise ácida com H2SO4 como uma reação de anidrido com álcool.
H2SO4 se dissocia em H+ e HSO4
- H+ presente no meio protona um dos oxigênios do anidrido acético fazendo com que
fique positivo e com apenas um par de elétrons.
- O oxigênio da hidroxila no ácido salicílico usa um de seus dois pares de elétrons para atacar o
carbono da carbonila do anidrido acético assumindo carga positiva.
- Ao mesmo tempo que ocorre o ataque, a ligação π entre o carbono e o oxigênio protonado se
quebra e o par de elétrons vai para o oxigênio.
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
- Ocorre transferência de prótons do oxigênio positivo para o oxigênio ligado a dois carbonos,
que assume uma carga negativa.
- A carbonila é restaurada e a ligação entre o oxigênio que recebeu o próton e o carbono se
quebra e ácido acético é expulso da molécula.
- HSO4- presente no meio retira um próton do oxigênio formando o ácido acetilsalicílico.
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
4.2. Precipitação do AAS
Após a mistura dos reagentes ter sido retirado do banho maria, deveríamos observar a
precipitação do AAS assim que ocorre-se o resfriamento do meio reacional, porém não foi o
ocorrido na prática. Portanto, a indução de precipitação foi feita, após voltar com o frasco para o
banho maria, por mais 5 minutos, e em seguida colocar o frasco no banho de gelo e atritar as
paredes com o bastão de vidro. O filtrado obtido foi um pó cristalino e inodoro.
4.3. Recristalização do AAS
Primeiramente, foi feito o teste de solubilidade do composto, colocou-se uma pequena
quantidade da amostra em tubos de ensaio e adicionou-se um pouco de H2O (fria) e etanol para a
realização do teste de solubilidade. O solvente que solubilizou o AAS foi o etanol, após tal
constatação seguimos para o teste do quanto de amostra era necessário para que o tubo de ensaio se
turvasse e a amostra fosse totalmente solubilizada. Em seguida, em um erlenmeyer colocamos um
pouco da amostra e adicionamos 1,5mL de H20 à quente e 3mL de etanol à quente. O meio
descansou para que ocorresse a recristalização.
4.4 Rendimento
O rendimento foi calculado com base no valor do reagente limitante que neste caso foi ácido
salicílico, e tomando como base o que ficou retido no papel de vidro. Logo por regra de três obteve-
se o rendimento em porcentagem da reação, como demostrado abaixo.
1 mol --------- 180,158g 100% ------- 2,70237g
0,015 mol --- X X -------- 1,920g
X = 2,70237g X = 71%
A reação de síntese do ASS obteve um rendimento de 71%.
4.5. Ponto de Fusão
A amostra de ácido acetilsalicílico presente no capilar em óleo foi observada atentamente, até
que à 132ºC o sólido começou a liquefazer. Aos 134ºC o sólido estava completamente liquefeito.
O processo foi repetido com a nova amostra e os resultados foram muito parecidos. O ácido
acetilsalicílico fundiu completamente aos 96ºC. O resultado diverge do ponto de fusão apresentado
na literatura de 135ºC (Teves, 2003). Isso se deve ao fato de que a amostra utilizada para a
determinação do ponto de fusão não havia passado por processo de recristalização, e, portanto,
continha impurezas. A presença de impurezas reduz o ponto de fusão e alarga a faixa de fusão.
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
GOVERNO DO ESTADO DO RIO DE JANEIRO
SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA
FUNDAÇÃO CENTRO UNIVERSITÁRIO ESTADUAL DA ZONA OESTE
5. Conclusões
Na aula prática foi possível sintetizar o ácido acetilsalicílico através da reação entre o ácido
salicílico e o anidrido acético em catálise ácida por ácido sulfúrico e determinar o seu ponto de
fusão.
6. Referências Bibliográficas
FELTRE, RICARDO. Fundamentos da Química. 3. Ed. São Paulo: Editora Moderna,. 2001.
CAREY, FRANCIS. Química Orgânica. 7. Ed. Porto Alegre: AMGH Editora Ltda, 2011.
SCHROR, K. Acetysalicylic Acid. Weinheim. Wiley-Blacwell, 2009.
Bayer HealthCare LLC. “Sobre a Aspirina®”. 2016. Disponível em:
https://www.aspirina.com.br/pt/sobre-aspirina/historia/. Acesso em: 30/12/2019.
MENDES, ALINE SOUZA, PERUCH, MARIA DA GLORIA BUGLIONE, FRITZEN,
MARCIO. “Síntese e purificação do ácido acetilsalicílico através da recristalização utilizando
diferentes tipos de solventes”. Revista eletrônica Estácio Saúde, vol. 1, 2012.
DA LUZ, LESLIE TAUANY, GOMES, SANDRA INÊS, SANDRI, MARILEI, DE MELLO,
FLÁVIA, BOLZAN, JULIANA. “Evaluation and optimization of the conditions for obtaining
acetilsalicylic acid for didactic purposes”. Educ. quím, vol.30, 2019.
Luciana da Cunha Costa (Luciana.cunha.costa@gmail.com)
Centro Universitário Estadual da Zona Oeste - UEZO
AV. MANUEL CALDEIRA DE ALVARENGA, 1.203 – CAMPO GRANDE, RIO DE JANEIRO, RJ – CEP 23.070-200 – TEL. (21) 2332-7533
________________________________________________________________________________________________________
Você também pode gostar
- Guia Prático Para Reduzir As Despesas Mensais Com A Sua CasaNo EverandGuia Prático Para Reduzir As Despesas Mensais Com A Sua CasaAinda não há avaliações
- Síntese e Caracterização Da P-NitroanilinaDocumento5 páginasSíntese e Caracterização Da P-NitroanilinaThamyris Santos-Silva100% (3)
- Síntese Do Ácido AcetilsalicilicoDocumento12 páginasSíntese Do Ácido AcetilsalicilicoJackson Luiz Martins Godinho100% (1)
- Atividade Laboratorial 1.1 Quimica 11anoDocumento5 páginasAtividade Laboratorial 1.1 Quimica 11anoSimão Simões67% (3)
- Sintese Da AspirinaDocumento7 páginasSintese Da AspirinaMariah CorreiaAinda não há avaliações
- Determinação Da Quantidade de Ácido Acetil SalicílicoDocumento15 páginasDeterminação Da Quantidade de Ácido Acetil SalicílicoGesiane G. Ferreira100% (4)
- Ácidos Carboxílicos e DerivadosDocumento57 páginasÁcidos Carboxílicos e DerivadosTatiane Barcellos SilvaAinda não há avaliações
- Relatório de Síntese Da AspirinaDocumento14 páginasRelatório de Síntese Da Aspirinaigorbest1776Ainda não há avaliações
- Relatório Síntese Do Ácido AcetilsalicílicoDocumento6 páginasRelatório Síntese Do Ácido AcetilsalicílicoAnderson LuizAinda não há avaliações
- Sintese AASDocumento5 páginasSintese AASHenrique SeidelAinda não há avaliações
- Síntese Do Ácido AcetilsalicílicoDocumento16 páginasSíntese Do Ácido AcetilsalicílicoHeidelanna Cilibelly100% (1)
- Síntese de Aspirina® (Ácido Acetilsalicílico)Documento11 páginasSíntese de Aspirina® (Ácido Acetilsalicílico)LuanaAinda não há avaliações
- Síntese Do Ácido AcetilsalicílicoDocumento8 páginasSíntese Do Ácido AcetilsalicílicocaelAinda não há avaliações
- Relatório - Preparação Da AcetanilidaDocumento9 páginasRelatório - Preparação Da AcetanilidaDiogo CoelhoAinda não há avaliações
- Roteiro de Aulas Práticas QFMDocumento12 páginasRoteiro de Aulas Práticas QFMCharllyton CostaAinda não há avaliações
- Relatório - Síntese Do AASDocumento14 páginasRelatório - Síntese Do AASKarenRodriguesAinda não há avaliações
- Funcoes Nitrogenadas e OutrasDocumento44 páginasFuncoes Nitrogenadas e OutrasClaudenor PiedadeAinda não há avaliações
- RespostasDocumento4 páginasRespostasMaicon Vinícius100% (3)
- Síntese Do Ácido AcetilsalicílicoDocumento8 páginasSíntese Do Ácido AcetilsalicílicoFernanda MattosAinda não há avaliações
- Apostila Orgânica Experimental Ii 2021Documento38 páginasApostila Orgânica Experimental Ii 2021Nathália AmaralAinda não há avaliações
- 6° Cristalização - Purificação de SubstaânciaDocumento12 páginas6° Cristalização - Purificação de SubstaâncialayyslimaAinda não há avaliações
- Extração e Recristalização Do Ácido AcetilsalicílicoDocumento15 páginasExtração e Recristalização Do Ácido AcetilsalicílicoGabrielaPSouzaAinda não há avaliações
- Relatório AAS Pronto.Documento16 páginasRelatório AAS Pronto.Lenon NevesAinda não há avaliações
- Al1 1-SantillanaDocumento2 páginasAl1 1-SantillanaiolaAinda não há avaliações
- qr11 02 Teste Aval 2 sd1 EnunciadoDocumento6 páginasqr11 02 Teste Aval 2 sd1 EnunciadocarmenfilipapereiracasimiroAinda não há avaliações
- Relatório Sintese de AcetanilidaDocumento9 páginasRelatório Sintese de AcetanilidaLetícia OliveiraAinda não há avaliações
- Amidos Modificados 2Documento41 páginasAmidos Modificados 2oacrisosAinda não há avaliações
- Relatorio - Síntese Do Ácido Acetilsalicílico (Aas) - Passei DiretoDocumento10 páginasRelatorio - Síntese Do Ácido Acetilsalicílico (Aas) - Passei DiretoJOANA SCAPINIAinda não há avaliações
- Trabalho Sintese AAS1Documento10 páginasTrabalho Sintese AAS1Andria Carolina Da Silva LopesAinda não há avaliações
- Relatorio Sobre Sintese Do AASDocumento12 páginasRelatorio Sobre Sintese Do AASDaniela SilvaAinda não há avaliações
- Síntese Do Ácido AcetilsalicílicoDocumento8 páginasSíntese Do Ácido AcetilsalicílicocaelAinda não há avaliações
- Aula 4 - Síntese Da AspirinaDocumento3 páginasAula 4 - Síntese Da AspirinaFree FireAinda não há avaliações
- Relatório ORG2Documento17 páginasRelatório ORG2Eduardo Fernandes SacconAinda não há avaliações
- Trabalho de Sintese e Recristalização Do AasDocumento12 páginasTrabalho de Sintese e Recristalização Do AasMatheus AlbuquerqueAinda não há avaliações
- Relatorio de Sintese Do AcetilsalicilicoDocumento5 páginasRelatorio de Sintese Do AcetilsalicilicoAriane FerrazAinda não há avaliações
- Relatorio - Sintese Da AspirinaDocumento7 páginasRelatorio - Sintese Da AspirinataynarAinda não há avaliações
- Relatorio Síntese Da AspirinaDocumento10 páginasRelatorio Síntese Da AspirinaGiovanna martinsAinda não há avaliações
- REL - Sintese Do AASDocumento4 páginasREL - Sintese Do AASAlberto GomesAinda não há avaliações
- Relatório Al 1.1 ModificadoDocumento11 páginasRelatório Al 1.1 ModificadoMafalda MoreiraAinda não há avaliações
- Relatório de Experimento 2 e 3 - Isabella DinizDocumento9 páginasRelatório de Experimento 2 e 3 - Isabella DinizIsabella Cristina Diniz CostaAinda não há avaliações
- RELATORIO QUIM ORG - AspirinaDocumento11 páginasRELATORIO QUIM ORG - AspirinaCarole MassolarAinda não há avaliações
- Pratica 02 RelatorioDocumento9 páginasPratica 02 RelatorioClarissa Bianco100% (1)
- Roteiro - SÍNTESE DO AASDocumento4 páginasRoteiro - SÍNTESE DO AASadecirsilva2Ainda não há avaliações
- Relatório Sobre A Síntese Do Ácido AcetilsalicílicoDocumento7 páginasRelatório Sobre A Síntese Do Ácido AcetilsalicílicoInêsAinda não há avaliações
- Renata Martins - AL1.1Documento3 páginasRenata Martins - AL1.1Cesar RebeloAinda não há avaliações
- Relatório 3 - Síntese Do Ácido Acetilsalicílico - Passei DiretoDocumento9 páginasRelatório 3 - Síntese Do Ácido Acetilsalicílico - Passei DiretoJOANA SCAPINIAinda não há avaliações
- Aspirin ADocumento16 páginasAspirin Aweberbr2010Ainda não há avaliações
- Síntese Da AspirinaDocumento8 páginasSíntese Da AspirinaRomário Oliveira100% (1)
- Teor de Ácido AcetilsalicílicoDocumento13 páginasTeor de Ácido AcetilsalicílicoClara SantosAinda não há avaliações
- Relátorio AasDocumento12 páginasRelátorio AasGuilherme da Silva FigueiredoAinda não há avaliações
- SÍNTESESDocumento21 páginasSÍNTESESIvana RibeiroAinda não há avaliações
- Relatório 7Documento8 páginasRelatório 7Thais AntunesAinda não há avaliações
- Relatório 2 - Ácido AcetilsalicílicoDocumento3 páginasRelatório 2 - Ácido AcetilsalicílicoRafael Guimarães RamosAinda não há avaliações
- Relatório IV - Ácido AcetilsalicílicoDocumento7 páginasRelatório IV - Ácido AcetilsalicílicoBeatriz KrugerAinda não há avaliações
- 3 - Hidrólise Do Ácido AcetilsaliclicoDocumento3 páginas3 - Hidrólise Do Ácido AcetilsaliclicoSheldon CooperAinda não há avaliações
- 2° Relatório de Química Orgânica - Síntese Da Aspirina - ImpressãoDocumento15 páginas2° Relatório de Química Orgânica - Síntese Da Aspirina - ImpressãoRaisa RiccioAinda não há avaliações
- Relatório de Mecanismo Prática Síntese Da AcetanilidaDocumento7 páginasRelatório de Mecanismo Prática Síntese Da AcetanilidaEuriany araujo sousaAinda não há avaliações
- Al 1 Trabalho Oranizado de Fisica 2Documento6 páginasAl 1 Trabalho Oranizado de Fisica 2a 3154Ainda não há avaliações
- Relatorio - Alcoois Aldeidos e CetonasDocumento6 páginasRelatorio - Alcoois Aldeidos e CetonastaynarAinda não há avaliações
- Experimento qg109Documento9 páginasExperimento qg109CarolinaDeMoraesAgostinhoAinda não há avaliações
- Relatório Técnicas Basicas de LaboratórioDocumento10 páginasRelatório Técnicas Basicas de LaboratórioFernando BatistaAinda não há avaliações
- Relatorio Sintese Do Salicilato de Metila Formatado Sem ConclusãoDocumento10 páginasRelatorio Sintese Do Salicilato de Metila Formatado Sem ConclusãoRicardo CastilloAinda não há avaliações
- Síntese Do Ácido AcetilsalicílicoDocumento2 páginasSíntese Do Ácido Acetilsalicílicoleonor.tinoco1810Ainda não há avaliações
- Relatório Experimento 4Documento11 páginasRelatório Experimento 4paulorroAinda não há avaliações
- Sintese Do ASSDocumento10 páginasSintese Do ASSLahis CrespoAinda não há avaliações
- Relatório 1 ProntoDocumento7 páginasRelatório 1 ProntoMyllaAinda não há avaliações
- 22 Super Benefícios do Bicarbonato de Sódio: O bicarbonato de sódio tem uma variedade de usos domésticos adicionais e benefícios à saúdeNo Everand22 Super Benefícios do Bicarbonato de Sódio: O bicarbonato de sódio tem uma variedade de usos domésticos adicionais e benefícios à saúdeAinda não há avaliações
- Síntese Do Ácido Acetil SalicílicoDocumento7 páginasSíntese Do Ácido Acetil SalicílicoLucas José KarasAinda não há avaliações
- Teste Formativo Sobre AL 1-11QDocumento2 páginasTeste Formativo Sobre AL 1-11QLeonor PecurtoAinda não há avaliações
- FPP 2017 VerãoDocumento102 páginasFPP 2017 VerãolunaAinda não há avaliações
- 2° Relatório de Química Orgânica - Síntese Da Aspirina - ImpressãoDocumento15 páginas2° Relatório de Química Orgânica - Síntese Da Aspirina - ImpressãoRaisa RiccioAinda não há avaliações
- Tabela de IncompatibilidadeDocumento4 páginasTabela de Incompatibilidademmantovani57Ainda não há avaliações
- NR 13 - Explosão Na Planta Química Da Hoecht-CelaneseDocumento12 páginasNR 13 - Explosão Na Planta Química Da Hoecht-CelaneseCPSSTAinda não há avaliações
- Parte3-FIBRAS TÊXTEIS QUÍMICASDocumento41 páginasParte3-FIBRAS TÊXTEIS QUÍMICASfmaesta0% (1)
- Eq11 Dossie Prof Teste Aval Global 1Documento7 páginasEq11 Dossie Prof Teste Aval Global 1Mafalda MatiasAinda não há avaliações
- Produtos Químicos IncompatíveisDocumento3 páginasProdutos Químicos IncompatíveisDébora EirizAinda não há avaliações
- Armazenagem de Produtos QuímicosDocumento4 páginasArmazenagem de Produtos QuímicosJorge Ferreira Junior100% (1)
- Fisica e Quimica - 1684782459.641182984Documento11 páginasFisica e Quimica - 1684782459.641182984Maria Eduarda Avelino AragãoAinda não há avaliações
- Relatório PARACETAMOLDocumento12 páginasRelatório PARACETAMOLIsabela Nascimento75% (4)
- Práticas de Laboratório de OrgânicaDocumento75 páginasPráticas de Laboratório de OrgânicaAndersonAinda não há avaliações
- Questionario 8Documento4 páginasQuestionario 8Roseane AlvesAinda não há avaliações
- A.L. 1.1Documento3 páginasA.L. 1.1Ana Patricia100% (1)
- Questionário IiDocumento8 páginasQuestionário Iitatiane100% (1)
- Pré-Relatório 1 - Síntese Da AcetanilidaDocumento3 páginasPré-Relatório 1 - Síntese Da AcetanilidaVictor GuedesAinda não há avaliações
- Relatorio Diacetato de HidroquinonaDocumento20 páginasRelatorio Diacetato de Hidroquinonanorbertokv100% (2)
- NITRAÇÃO DA ACETANILIDA E SINTESE DA p-NITROANILINADocumento3 páginasNITRAÇÃO DA ACETANILIDA E SINTESE DA p-NITROANILINABiah MolinaAinda não há avaliações