Escolar Documentos
Profissional Documentos
Cultura Documentos
RESUMO DM - Parte 1
Enviado por
Jorge Kayro Fernandes dos Santos SEDE II UCPDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
RESUMO DM - Parte 1
Enviado por
Jorge Kayro Fernandes dos Santos SEDE II UCPDireitos autorais:
Formatos disponíveis
Maria Katarina D’ Caminha – Medicina
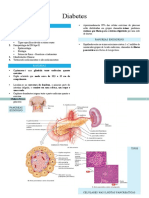
Diabetes Mellitus
Parte 1
Definição: Catabolismo: decomposição desses polímeros
É uma doença do metabolismo intermediário, em suas respectivas unidades moleculares.
caracterizada fundamentalmente pela ocorrência de O Metabolismo intermediário é controlado por
HIPERGLICEMIA CRÔNICA, que em longo prazo hormônio.
promove lesão de órgãos-alvo, podendo cursar com - A insulina é o principal do anabolismo
descompensações metabólicas agudas. - Glucagon, adrenalina, cortisol e GH
- Complicações micro ou macrovasculares medeiam o catabolismo.
- Aumento da morbidade Equilíbrio dinâmico entre o anabolismo e
- Redução da qualidade de vida catabolismo.
- Elevação da taxa de mortalidade Período pós-prandial – predominam reações de
Etiopatogenia: anabolismo, devido os altos níveis de insulina.
- Déficit de insulina (absoluto ou relativo) Período de jejum predominam reações de
- Resistência à insulina catabolismo, pela queda da insulina e aumento dos
Resultado final: contrarreguladores.
- Diminuição da utilização periférica
- Aumento da produção hepática de glicose. Níveis séricos Glicose → Clivagem da Pró-insulina
Fisiologia – Metabolismo Intermediário Insulina Peptídeo C
Conjunto de reações bioquímicas orgânicas de
A Glicose entra no citoplasma através dos canais
síntese e degradação de macromoléculas (proteínas,
GLUT 1 e 2.
carboidratos e lipídios)
- Inicio da Glicólise com formação de ATP
Os carboidratos e lipídios são essencialmente,
- Fechamento dos canais ATP-sensíveis →
moléculas de reserva energética.
despolarização celular → influxo de cálcio →
Anabolismo: é o conjunto de reações de síntese
degranulação
das macromolécula através da formação de
O glucagon é um hormônio peptídico, sintetizado
polímeros:
e liberado pelas células-alfa em resposta à redução
- Aminoácidos formam proteínas
dos níveis séricos de glicose
- Glicose forma glicogênio
- Ác. Graxos + Glicerol = triglicerídeos
A Glicose é a grande fonte de energia dos
neurônios.
- Sem reserva de glicose, o SNC
rapidamente entra em colapso na vigência de
neuroglicopenia.
Na falta de glicose, o fígado produz corpos
cetônicos a partir dos ácidos graxos, que podem ser
usados como “combustível alternativo” pelos
neurônios.
➔ Estado de Jejum (Interprandial):
- Risco de cetoacidose acidose metabólica
Terminada a absorção intestinal de nutrientes, os
com ânion-gap aumentado causado pelo excesso de
níveis séricos de glicose, aminoácidos e lipoproteínas
corpos cetônicos.
tendem a se reduzir → inibição da liberação de
insulina, com estímulo à secreção de
➔ Estado pós-prandial:
contrarreguladores.
A glicose estimula liberação de insulina, em 2
Promove:
etapas:
- Catabolismo
- 1° Etapa: pico precoce, liberada a partir de
- Utilização de ácidos graxos como principal
grânulos pré-formados, aumentando seus níveis
substrato energético.
séricos em cerca de 2-10 minutos.
1) Catabolismo dos carboidratos:
- 2° Etapa (tardia): insulina é secretada de
- O glicogênio hepático é clivado, liberando
forma sustentada.
glicose para o sangue – GLICOGENÓLISE.
Promove:
2) Produção Hepática de Glicose:
- Anabolismo
- GLICONEOGÊNESE: síntese hepática de
- Utilização de glicose como principal
glicose a partir de molécula não glicídicas, devido ao
substrato energético.
esgotamento do glicogênio hepático.
3) Catabolismo dos Lipídios:
- Clivagem dos triglicerídeos, liberando ác.
Graxos livres – LIPÓLISE, gerando substrato
energético.
- CETOGÊNESE: se a liberação de ác graxos
for excessiva, uma parte será aproveitada pelo
hepatócito para a síntese de corpos cetônicos. Classificação:
“Cetose de jejum”. DM tipo 1 (5-10%)
4) Catabolismo das proteínas: - Destruição primária das células beta e
- PROTEÓLISE: proteínas são quebradas em hipoinsulinismo “absoluto”.
aminoácidos - Tipo 1A – mecanismo autoimune (90%)
- Tipo IB – idiopático (4-7%)
INCRETINAS: - Predomina em pacientes jovens não
- São peptídeos secretados pelo tubo obesos.
digestivo durante a absorção de nutrientes. - Associação com o HLA
- Função de aumentar a secreção - LADA (30%) – aparece após os 30 anos.
pancreática de insulina em resposta à glicose, através Progressão do déficit insulínico é lenta, podendo ser
da estimulação da célula B. confundido com DM tipo 2.
- O GLP-1 e GIP aumentam a captação de DM tipo 2 (80-90%): + comum
glicose periférica e diminuem a glicose em jejum - Resistência periférica à insulina
pós-prandial. - Disfunção progressiva das células beta
- Promovem saciedade → diminuição da (“exaustão” secretória).
ingesta alimentar. - Hipoinsulinismo “relativo” – início do quadro
- Retarda o esvaziamento gástrico → a insulina aumenta, porém, esse aumento é
redução da glicemia pós-prandial. insuficiente para controlar a glicemia.
- GLP-1 e GIP → ambas são degradadas pela - Predomina em obesos (>45 anos)
enzima DPP-IV. - Maior concordância em gêmeos univitelinos
- O GLP-1 vai causar diminuição do glucagon DM gestacional:
→ diminuição da produção de glicose pelo fígado. - Intolerância à glicose diagnosticada durante
a gestação.
Devido à carência de insulina, o organismo do - Gestação → aumento hormonal
diabético se comporta como se o paciente estivesse (estrogênio, cortisol, lactogênio placentário) +
constantemente em estado de jejum, mesmo no enzimas placentárias (degradam insulina) →
período pós-prandial. O catabolismo e a glicogênese aumento da glicemia.
ficam constantemente estimulados, explicando a - Geralmente volta ao normal depois da
hiperglicemia crônica (pré e pós prandial) gravidez.
Outros:
- DM associado ao uso de drogas
- Endocrinopatias - Defeito no receptor da ação da insulina →
- Defeitos genéticos na função da célula B resistência à ação da insulina → Hiperglicemia.
- Secundário a doenças do pâncreas ➔ Doenças do Pâncreas exócrino:
exócrino (pancreatite)
- Secundário à infecções
- Defeitos genéticos na função da célula B
(MODY)
➔ Defeitos genéticos na função da célula B
(MODY) - Destruição das células beta pancreáticas
produtoras de insulina.
- Pacreatite crônica principalmente de causa
etílica.
➔ Endocrinopatias:
- Geralmente pacientes jovens (< 30 anos),
magros.
- Defeito autossômico dominante: 3 - Diminuição da secreção de insulina.
gerações acometidas ➔ Diabetes induzido por medicamentos
- O + comum é o MODY 2 e MODY 3
- O MODY 2 na maioria das vezes não
precisa de medicação, é controlado com MEV.
- O MODY 3 é + grave, vai ter uma
hiperglicemia que necessita de insulina, e possíveis
complicações.
➔ Defeitos Genéticos na ação da Insulina:
- Determinadas toxinas e a Pentamidina
destroem as células beta pancreáticas
- Ác. Nicotínico e Glicocorticoides aumentam
a resistência à insulina.
- Tiazídicos diminuem a secreção de insulina - DR3 e DR4
- Interferon pode produzir autoanticorpos Peptídeo C sérico vai estar baixo.
contra as células beta e destruir essas células. As ilhotas de Langerhans são invadidas por
➔ Outras formas de DM: linfócitos T citotóxicos (CD8+) que destroem
seletivamente as células beta → surgimento de
autoanticorpos
- Anti-Ilhota (ICA) = 80%
- Anti-GAD = 70% (é o que fica positivo por
mais tempo)
- Anti-IA-2 = 60%
- Essas infecções podem cursar com Esses marcadores aparecem ANTES da
infecção do pâncreas e destruição das células beta expressão clínica da doença → fase assintomática
e produção de autoanticorpos. (pré-diabético)
➔ Síndromes Genéticas associadas ao DM: Quando a massa de células beta atinge um ponto
“crítico” (80-90% de destruição), eventos como a
puberdade e infecções intercorrentes induzem a
instalação abrupta dos sintomas
- A cetoacidose diabética pode ser a primeira
manifestação da doença em 30% dos casos.
Apesar da natureza autoimune da doença, não
há evidências que corroborem o uso profilático de
imunossupressores.
Etiopatogenia do DM tipo 1: Portadores do DM tipo 1 dependem, pelo resto da
vida, da reposição de insulina exógena.
DM tipo 1A é uma doença autoimune –
Incidência bimodal:
marcadores positivos
- Pico entre 4-6 anos
Interação entre fatores genéticos e ambientais
- Outro pico entre 10-14 anos
Infecções virais e/ou exposição a antígenos,
Não há diferença entre os sexos.
através do mimetismo molecular → insulite
A etiopatogenia do tipo 1B é desconhecida –
(inflamação das ilhotas pancreáticas)
marcadores negativos.
Alguns genes contribuem para essa
História Natural do DM1:
predisposição.
- Genes HLA
- 1° Suscetibilidade genética – tendência a - Aumento da lipólise
desenvolver a doença, com o fator lesional que pode - Aumento da reabsorção de glicose
ser vírus, dieta, toxinas, vai desencadear a - Diminuição da captação de glicose
autoimunidade para destruir as células Beta. - Disfunção de neurotransmissores
- Fase Assintomática → anticorpos positivos - Aumento da produção hepática de glicose
e glicemia dentro do normal. - Aumento da secreção de glucagon.
- Fase Metabólica → já tem resistência a Hipoinsulinismo “relativo”:
insulina, se fizer um teste oral de tolerância a glicose - A insulina pode estar “normal” ou mesmo
já vem alterado. alta, mas é sempre insuficiente para manter a
- Diabetes: Glicemia já está alta e os níveis homeostase da glicose.
de peptídeo C e insulina estão baixos. Interação entre fatores genéticos e ambientais.
Obesidade e inatividade física desencadeiam a
resistência à insulina.
A hiperglicemia crônica, juntamente com a
hiperlipidemia, agrava a resistência à insulina e o
déficit secretório → ciclo vicioso que evolui com
descompensação metabólica progressiva.
Resulta em:
- Menor captação e utilização da glicose por
tecidos periféricos, adiposo (menor inibição da
lipólise), hepático (menor inibição da gliconeogênese
Etiopatogenia do DM tipo 2: – ocasionando maior produção hepática de glicose).
Etiologia complexa e multifatorial: Fase inicial:
- Genética: mais fatore genético que o tipo 1 - Hipossensibilidade da célula beta à glicose,
- Ambientais: dieta e inatividade física. devido à menor expressão do canal de glicose
Em 80 a 90% dos casos, associa-se ao excesso GLUT-2 na membrana.
de peso e à sd. metabólica. - Deficiência de incretinas
Peptídeo C vai estar normal ou elevado - Consequência: resposta subnormal na
Fatores que justificam a hiperglicemia: secreção de insulina pós-prandial, justificando a
- Resistência à insulina hiperglicemia neste período.
- Déficit secretório das células beta Fases mais avançadas:
- Diminuição do efeito de incretinas - Grau de destruição das células beta
- Necessário insulinização - Aumento de ác. Graxos livres e TG no
Fatores de risco: sangue → aumento da utilização desses no músculo
- História familiar da doença → diminui utilização de glicose → hiperglicemia.
- Avançar da idade (> 45 anos)
- Obesidade
- Sedentarismo
- Dx prévio de diabetes ou diabetes
gestacional
- Presença de componentes da Sd.
metabólica. (HAS e dislipidemia)
- História de dç. cardiovasculares
- HDL < 35mg/dL Glicotoxicidade:
- Triglicerídeos > 25 mg/dl - O fígado utiliza os ác. Graxos para formar
- Síndrome de ovário policísticos glicose (GLICONEOGÊNESE) → hiperglicemia.
- Acantose nigricans História Natural do Diabetes tipo 2:
O acúmulo de gordura visceral produz citocinas
pró-inflamatórias e gera resistência à insulina.
Fisiopatologia do DM2:
- Normal: com a alimentação tem 2 fases de
liberação de insulina:
1) Liberação da insulina já estocada
2) Produção de insulina. - 1° fase: diminuição da atividade da célula beta
- No DM: acontece: → aumento da resistência à insulina. A princípio a
1) Perda de 1° fase de secreção da insulina também aumenta para vencer a resistência.
insulina → aumento da glicemia pós-prandial. - Glicemia jejum normal e pós-
2) Aumento da glicemia em jejum prandial normal.
Lipotoxicidade: - 2° Fase: diminuição da secreção de insulina
- Aumento de ác. Graxos livres e e não consegue vencer a resistência.
triglicerídeos no sangue → toxicidade nas células - Aumento da glicemia pós-prandial
beta pancreáticas → redução da secreção de inicialmente, e depois a glicemia em jejum.
insulina → Hiperglicemia Antes do diagnóstico já pode ter tanto
complicações micro ou macro vasculares.
Quadro Clínico e Diagnóstico: - Lesão cutânea hiperpigmentada e de
1) Quadro Clínico do DM tipo 1: aspecto aveludado que predomina em áreas de
Quadro clássico e início AGUDO dobra cutânea.
- Poliúria, polidipsia, polifagia e - Decorre da estimulação de queratinócitos e
emagrecimento. fibroblastos da pele (pela hiperinsulinemia).
Em crianças pequenas as primeiras
manifestações podem ser enurese noturna e 3) Estados pré-diabéticos:
candidíase vaginal. Pessoas com alta probabilidade de desenvolver
LADA: DM tipo 2 em curto prazo.
- Início insidioso (anos) Doença pode ser evitada nessa fase
- Hipoinsulinismo absoluto com o passar do Critérios:
tempo. - Glicemia de jejum alterada (100-125 mg/dl)
- Manifestações clínicas características de - Intolerância à glicose = glicemia 2hr após o
DM tipo 1. TOTG 75 entre 140-199 mg/dl
- Hb glicada entre 5,7 – 6,4%
2) Quadro Clínico do DM tipo 2: Conduta:
Costuma ser tardio, anos ou décadas - Orientação nutricional + Ativ. Físicas regular
completamente assintomáticos - Cessação do tabagismo
Paciente típico: A metformina pode ser indicada em casos de
- Adulto ( > 40-45 anos) muito alto risco, ou seja:
- Obeso - Presença de múltiplos fatores de risco para
- Sedentário DM tipo 2
- Outros fatores de risco cardiovascular. - Piora progressiva do controle glicêmico a
Sintomas de franca hiperglicemia (poliúria, despeito das MEV.
polidpsia)
Raro ter cetoacidose diabética 4) Rastreio Populacional:
As vezes o dx. é decorrente do estado Objetivo de detectar a doença precocemente na
hiperosmolar não cetótico (principal complicação população assintomática.
aguda do DM2). Indicações:
Acantose Nigricans: - Idade ≥ 45 anos
- Importante sinal clínico. - Pacientes com pré-diabetes
- Mulheres com diagnóstico prévio de DM - Ela vai refletir o controle metabólico dos
gestacional últimos 3 meses, sendo 50% do último mês, 25%
- Indivíduos com IMC ≥ 23 kg/m2 + pelo no segundo mês e 25% no terceiro mês.
menos 1 dos fatores de risco p/diabetes. - Deve ser padronizada pelo programa
Fazer glicemia em jejum nacional de padronização de glico-hemoglobina.
Confirmação Diagnóstica: Metas Laboratoriais para o Tratamento do
Demonstração laboratorial de hiperglicemia DM:
Critérios diagnósticos:
- Hb glicada (A1C) ≥ 6,5%* ou
- Glicemia de jejum ≥ 126 mg/dL ou
- Glicemia 2h após TOTG-75≥ 200mg/dL ou
- Glicemia aleatória ≥ 200 mg/dL + sintomas
de hiperglicemia (“polis”)
Todos os demais precisam ser confirmados numa A modificação terapêutica é obrigatória quando
segunda dosagem, se não tiver uma clara as metas não estiverem sendo alcançadas ou na
hiperglicemia aguda. presença de glicemias muito baixas.
A medida da Hb glicada não substitui a medida das
Glicem Glicose 2 Glicose ao Hb glicada
ia em hr após acaso glicemias capilares, que fornecem informação sobre
jejum 75g de
glicose
a glicemia atual, devendo, portanto, ser usadas em
Normoglicemia < 100 < 140 - < 5,7% conjunto.
Pré-diabetes ou ≥ 100 e ≥ 140 e < - ≥ 5,7 e <
risco aumentado < 126 200 6,5 Níveis de HbA1C > 7% estão proporcionalmente
para DM
Diabetes ≥ 126 ≥ 200 ≥ 200 com ≥ 6,5 associados a risco aumentado de complicações
estabelecido sintomas
inequívocos crônicas em particular as microvasculares: retinopatia,
de
hiperglicemia nefropatia e neuropatia
Durante a gestação, os níveis de HbA1C não
Hemoglobina Glicada: devem ser utilizados como parâmetro de avaliação,
- A glicemia vai se ligar irreversivelmente à pois podem demorar dois meses ou mais para
Hb formando a chamada Hb glicada. Quanto maior a refletir a inadequação do tto.
glicemia, maior a Hb glicada. A Frutosamina é outra proteína glicosilada, que
reflete os níveis glicêmicos nas últimas 1-2 semanas.
É um método alternativo para avaliar o controle 3) Monitorização contínua da Glicemia:
glicêmico de pacientes que tenham condições que Realizada por um sensor posicionado no
alterem os valores da A1C. interstício que faz a leitura da glicose a cada 5
minutos
Tratamento: O desvio padrão avalia a variabilidade glicêmica
1) Não Medicamentoso: que deve ser idealmente < 50 mg/dl ou de, no
Plano de educação continuada e máximo, 1/3 da média das glicemias
automonitorização da glicose. O tempo no alvo indica quanto tempo o paciente
Mudanças no estilo de vida: permaneceu com as glicemias entre 70 e 180 mg/dl,
- Suspensão do fumo considera-se adequada a manutenção do alvo
- Baixo consumo de bebidas alcoolicas glicêmico em 50 a 60% do período avaliado.
- Manutenção do peso adequado
Plano de atividade física 4) Plano Alimentar e Atividade Física:
Plano alimentar Deve assegurar todas as necessidades nutricionais
do indivíduo com diabetes para que ele alcance e
2) Automonitorização da Glicemia Capilar: mantenha um peso corporal saudável
Diminui o risco de complicações agudas Fracionando em 5 a 6 refeições (3 principais e
(cetoacidose e hipoglicemia) 2-3 lanches)
Permite que o paciente entenda os Composição nutricional:
determinantes de sua glicemia com a ingestão de - Carboidratos totais: 45-60%, não inferior a
alimentos ou com a prática física 130g/dia (preferir carboidrato de baixo nível
Mínimo: 4x/dia (antes das principais refeições e glicêmico)
ao deitar) - Gordura total: 20-35% do VET, sendo 5-
Ideal: 6x/dia (antes e 2 horas após as refeições) 15% de ácidos graxos monoinsaturados
+ 1 x/mês de madrugada (3-4hr) - Proteínas: 15-20%
Situações especiais: - Fibras: 30-50g/dia (grãos integrais)
- Exercício intenso - Vitaminas e minerais: mínimo de 2-4
- Ajuste da insulina porções de frutas e 3-5 porções de hortaliças cruas
- Ingestão de carboidratos e cozidas
- Período de doenças - Sódio: < 2 gramas
Contagem de carboidratos (permite maior
flexibilidade das escolhas alimentares)
O álcool deve ser desencorajado, por aumentar - Pct não obesos c/ glicemia de jejum entre
tanto o risco de hipoglicemia, em usuários de insulina, 160-270 mg/dl.
quanto o risco de hiperglicemia. - Perda de peso na fase inicial da doença
Atividade física é uma medida promotora de Reduzem a glicemia em 20%
saúde, indicada de rotina em diabéticos, sendo o O aumento da secreção de insulina pode
DM2 o mais importante para controle da obesidade, provocar um aumento do peso do paciente
hipertensão e aumentar a sensibilidade. Observou-se redução das complicações
- No DM tipo 1 deve ter cuidado com o microvasculares (retinopatia, nefropatia e neuropatia)..
exercício físico extenuante. Falência secundária: resposta terapêutica começa
- O exercício aumenta a sensibilidade do a decair a cada ano de uso da droga.
músculo à insulina Fármacos:
- Primeira Geração: Clorpropramida,
5) Drogas Hipoglicemiantes: Tolbutamida, Tolazamida → precisa de uma dose
O tratamento medicamentoso vai depender da Efeitos adversos:
fisiopatologia - Hipoglicemia (+ com glibenclamida)
- Ganho de peso
- Efeitos no TGI: vômitos, náuseas e icterícia
colestática
- Retenção hídrica e hiponatremia:
clorpropamida. Principalmente se associado com
tiazídicos.
- Efeito antabuse-simile: associado à
Sulfoniluréias: clorpropamida.
Indicações: - Glimepirida: liberação + ágil de insulina, ao
- Pct não-obeso ou com perda de peso mesmo tempo em que permite menor duração de
Mecanismo de ação: secreção.
- Estimulam diretamente a secreção basal de Metabolismo e Eliminação:
insulina pelas células beta pancreáticas. - Todas são metabolizadas pelo fígado,
- Necessitam de uma célula beta funcionante devendo ter precaução em hepatopatas
(estimula a liberação e não a síntese) - Não deve ser usada em pct com dç. renal
Queda da Hb glicada de 1,0 – 2,0% Contraindicações:
Drogas preferidas em: - Doença renal e hepática avançada
- Situações de estresse ou trauma, infecções - Ganho ponderal discreto
graves - Redução do recondicionamento cardíaco
- Histórico de reações a SFUs ou seus pós-isquêmico
compostos. - Contraindicada na gravidez.
Glinidas ou Metglinidas: Biguanidas:
Medicamentos: 3 tomadas/dia Metformina, 3 mecanismos básicos:
- Repaglinida: 0,5 a 16 mg - Inibição da gliconeogênese hepática – 75%
- Nateglinida: 120 – 360 mg da ação hipoglicemiante
Administração antes das refeições - Melhora da sensibilidade dos tecidos
Não interfere no peso corporal periféricos à insulina
Mecanismo de ação: - Redução do turnover de glicose no leito
- Semelhante ao das sulfonilureias porém em esplênico.
receptor diferente na célula beta. - Ação na oxidação de ác. Grxos e na
Secretágogos de insulina de curta duração – hipertrigliceridemia → melhora perfil lipídico
controle da glicemia pós-prandial A nível celular a estimula a translocação do
Baixo risco de hipoglicemia - “equivalentes orais GLUT-4 e a atividade de glicogênio sintetase.
das insulinas de ação rápida” A Metformina é dependente da presença de
Metabolismo e excreção: insulina.
- Metabolização hepática A metformina não é metabolizada no fígado,
- Excreção Nteglinida é renal sendo excretada intacta na urina.
- Excreção Repaglinida é hepática (pode ser Diminuição significativa da incidência de
indicada em pact. Com insuficiência renal). complicações macrovasculares (AVE, IAM, morte
Redução da glicemia de jejum: 20-30 mg/dL cardíaca) em pacientes obesos.
(baixa) Posologia:
Redução de HbA1c: 1 – 1,5%. - Metformina 1 000 – 2500 mg VO/dia em 2
Metglinidas: tomadas.
- Redução do espessamento médio intimal - Início em doses baixas (500 mg) com
carotídeo (Repaglinida) aumento progressivo a cada 7 dias.
- Redução da variabilidade da glicose pós- - Sempre adm com a alimentação, que
prandial retarda a absorção da droga, reduzindo os efeitos
- Hipoglicemia gastrointestinais.
Não está relacionada com aumento de peso, e - Inibem a ação das enzimas digestivas do
pode contribuir para sua redução. tipo alfa-glicosidase presentes na borda em escova
Quando usada em monoterapia, não aumenta as dos enterócitos (clivam polissacarídeos complexos
chances de hipoglicemia. em monossacarídeos, como a glicose) → lentifica a
Redução da glicemia em 20% absorção intestinal de glicose → redução da glicemia
Redução da glicemia em jejum: 60 – 70 mg/dL pós-prandial.
Redução de HbA1c: 1,5 – 2% - Redução da relação LDL/HDL →
Metformina XR → liberação prolongada diminuição do risco cardiovascular.
- Redução dos efeitos colaterais Modesto efeito redutor da glicemia e HbA1c
- Metformina XR 500 – 2250 mg (queda de 0,9%).
Contraindicações: Posologia:
- Hepatopatas com transaminases - Arcabose 50 a 300 mg
- Insuficiência Renal (TFG < 30 mL/min Efeitos adversos:
- Durante estresse agudo (cirurgias) - TGI (metereorismo, desconforto abdominal
- Precaução em > 80 anos e diarreia)
- Gravidez - Elevação das transaminases
Orientações: - Hipoglicemia quando associada a SFU ou
- Monitorar os níveis séricos de vit. B12 em insulina.
usuários crônicos de metformina → reduz a + Indicadas:
absorção intestinal da vitamina - Hiperglicemia pós-prandial
- Deve ser suspensa 2 dias antes da - Pct idosos, não obesos, com hipoglicemia
realização de qualquer exame com contraste frequente ao usarem sulfoniluréia e glinidas
radiológico → para diminuir a chance de acidose - Terapia adicional combinada com outros
metabólica grave pelo uso de contraste nefrotóxico. antidiabéticos oral
Outras indicações: Contra-indicações:
- Síndrome de ovário policístico - Gravidez
- Esteato-hepatite não alcoolica - Doença inflamatória intestinal
- Pré-diabetes em pct de alto risco. Redução da glicemia de jejum: 20 – 30 mg/dL
Redução da HbA1c: 0,5 A 0,8%
Inibidores da alfa-glicosidase: Arcabose
Mecanismo de ação: Glitazonas:
Sensibilizadores periféricos de insulina
- Aumento da expressão dos receptores Contra-indicações:
periféricos de insulina. - Gravidez
Agem muito mais no estímulo à captação de - Insuficiência hepática
glicose pelo músculo esquelético do que no bloqueio - Insuficiência cardíaca classes I I e IV.
da gliconeogênese hepática.
Pode ser usada em monoterapia, porém é mais Gliptinas (Inibidores da DPP-4)
eficaz quando combinada a outros antidiabéticos Mecanismo de Ação:
orais ou a insulina. - Inibição seletiva da DPP-4, uma enzima que
Posologia: inativa o GLP-1 e o GIP → estimulam a secreção de
- Pioglitazona 15 a 45 mg 1 tomada/dia. insulina dependente de glicose.
Efeitos adversos: Bem toleradas e não causam aumento de peso
- Ganho ponderal de 2-3 Kg ou hipoglicemia.
- Edema em 5% dos casos, às vezes Efeitos adversos:
despompensando a ICC – devido o impacto na - Nasofaringite
permeabilidade tecidual e osmolaridade. - Cefaleia
- Ocorrência de perda da densidade mineral - Tontura
óssea e aumento de fratura atípica de ossos dos - Diarreia.
membros em mulheres. Representantes:
Deve ser evitada em pacientes com ICC classe - Sitagliptina 50 a 100 mg
funcional I I ou IV. - Vildagliptina 50-100 mg
Redução da glicemia de jejum: 35-65 mg/dL - Saxaglipitina 2,5 – 5 mg
Redução de HbA1c: 0,5 a 1,4% - Linagliptina 5 mg
Benefícios: - Alogliptina 6,25 a 25 mg
- Tecido adiposo: aumenta a diferenciação Redução da glicemia de jejum: 20 mg/dL
dos adipócitos e melhora as adipocinas Redução de HbA1c: 0,6 a 0,8%
- Macrófagos: diminui a inflamação É uma droga fraca
- Melhora a função do endotélio Desvantagens:
- Fígado: diminui a produção de glicose e - Angioedema e urticária
diminui esteatose - Possibilidade de pancreatite aguda
- Músculo: aumenta sensibilidade à insulina. - Aumento das interações por insuficiência
- Melhora o perfil lipídico. cardíaca (saxagliptina e eventualmente a alogliptina)
- Rara hipoglicemia Contraindicações:
- Hipersensibilidade aos componentes do - Náusea
medicamento. - Diarreias e vômitos
Linagliptina não requer ajuste de dose para - Pancreatite aguda
insuficiência renal – a preferível da classe na DRC. - Hipoglicemia, principalmente se associado a
secretagogos
Miméticos (agonista) e Análagos do GLP-1: - Aumento da FC
Fármacos que mimetizam as ações das incretinas - Injetável!!
- Aumento do nível de GLP-1, com aumento Redução da glicemia de jejum: 30 mg/dL
da síntese de insulina, e redução do glucagon Redução de HbA1c: 0,8 a 1,2%
- Retardo do esvaziamento gástrico Contraindicações:
- Saciedade a nível de SNC. - Sensibilidade e droga
Potencial extraglicêmico, em que a redução do
peso se apresenta como um dos principais
benefícios.
Representantes:
- Agonistas de curta duração: Exenatida,
liraglutida e Lixisenatida.
- Agonistas de longa duração: Exenatide long
acting release (LAR) e o dulaglutida.
- Exenatida 5 – 10 mcg 2x/dia Inibidores do SGLT2 ou Gliflozinas:
- Exenatida de liberação prolongada Mecanismo de ação:
2mg/semana SC - Inibe o receptor do cotransportador
- Liraglutida 0,6 a 1,8 mg sódio/glicose 2 (SGLT2) no túbulo renal proximal →
- Lixisenatida 10 – 20 mg inibe reabsorção de glicose → glicosúria.
- Dulaglutida 0,75 a 1,5 mg/semana SC REDUÇÃO DA MORBIMORTALIDADE CVC.
Vantagens: Efeitos colaterais:
- Redução do peso - Aumento da incidência de infecção urinária
- Redução da PA sistólica e candidíase vulvovaginal
- Rara hipoglicemia - Aumento da incidência de CA de bexiga (?)
- Redução da variabilidade pós-prandial Medicamentos:
- Redução de eventos cardiovasculares - Dapaglifozina 5 a 10 mg
Efeito adverso: - Empaglifozina 10 a 25 mg
- Canaglifozina 100 a 300 mg
Redução da glicemia de jejum: 30 mg/Dl
Redução de HbA1c: 0,5 a 1%
Vantagens:
- Rara hipoglicemia
- Redução de peso (2-3 Kg)
- Redução da PA → pelo efeito natriurético.
- Podem ser combinados com todos os
agentes orais e com a insulina.
Desvantagens:
- Infecção genital e urinária
- Poliúria, depleção de volume, hipotensão e
confusão mental
- Aumento do LDL-c
- Aumento transitório da creatinina
- Cetoacidose diabética.
Contraindicações:
- Disfunção renal moderada a grave (TFG ≤
60 mL/min)
➔ ESCOLHA DO AGENTE ANTIDIABÉTICO:
Levar em consideração:
- Estado geral, peso e idade do paciente
- Comorbidades presentes
- Valores de glicemias de jejum e pós-
prandial, bem como a HbA1c
- Eficácia do medicamento
- Risco de hipoglicemia
- Possíveis interações medicamentosas,
reações adversas e contraindicações
- Custo do medicamento
- Preferência do paciente.
Você também pode gostar
- Regulação Da Fome e SaciedadeDocumento6 páginasRegulação Da Fome e Saciedademônica conceiçãoAinda não há avaliações
- Problema 01 10Documento23 páginasProblema 01 10Karoline Silva ZampronhoAinda não há avaliações
- Prolactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoNo EverandProlactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoAinda não há avaliações
- Regulação Do Metabolismo - HORMÔNIOS 2023Documento42 páginasRegulação Do Metabolismo - HORMÔNIOS 2023Nádia SousaAinda não há avaliações
- Hormônios PancreáticosDocumento10 páginasHormônios Pancreáticosapi-3763569100% (1)
- Casos Clínicos I Diabetes MellitusDocumento17 páginasCasos Clínicos I Diabetes MellitusNadabia Alisson BatataAinda não há avaliações
- Farmacologia Da DiabetesDocumento10 páginasFarmacologia Da DiabetesAfiliado Lendário100% (1)
- Bioquímica Clínica - Unid IIDocumento46 páginasBioquímica Clínica - Unid IILuana BiniAinda não há avaliações
- 148633aula 1 - F.M. - Biologia - Fabricio Pinheiro - Rafael Cafezeiro - DiabetesDocumento18 páginas148633aula 1 - F.M. - Biologia - Fabricio Pinheiro - Rafael Cafezeiro - Diabetesanon_811630844Ainda não há avaliações
- Resumo Diabetes Tipos I e II - FarmacologiaDocumento24 páginasResumo Diabetes Tipos I e II - FarmacologiaLetícia MachadoAinda não há avaliações
- 1 - Pancreas e DiabetesDocumento71 páginas1 - Pancreas e DiabetesLucieny SouzaAinda não há avaliações
- 21 - Efeitos Metabólicos Da Insulina e Do Glucagon PDFDocumento3 páginas21 - Efeitos Metabólicos Da Insulina e Do Glucagon PDFLorenzo Salvestrini100% (1)
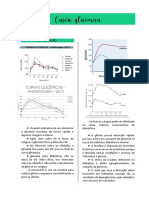
- Curva GlicêmicaDocumento4 páginasCurva GlicêmicaRê SilvaAinda não há avaliações
- Integr Regul Hormonal Metabolismo PDFDocumento52 páginasIntegr Regul Hormonal Metabolismo PDFLeandro CastilhaAinda não há avaliações
- Bioquímica Clínica - Aula 3 - Monitoramento DiabetesDocumento13 páginasBioquímica Clínica - Aula 3 - Monitoramento DiabetesValeskaSenaAinda não há avaliações
- Bioquímica Clínica - Aula 3 - Monitoramento DiabetesDocumento13 páginasBioquímica Clínica - Aula 3 - Monitoramento DiabetesValeskaSenaAinda não há avaliações
- Diabetes: Soi Iv - Apg 03Documento8 páginasDiabetes: Soi Iv - Apg 03Melissa TolentinoAinda não há avaliações
- FadaDocumento107 páginasFadaJesus O MESSIASAinda não há avaliações
- Estudo Dirigido FármacoDocumento2 páginasEstudo Dirigido Fármacoduda180504Ainda não há avaliações
- ENDOCRINOLOGIADocumento12 páginasENDOCRINOLOGIAKety ChavesAinda não há avaliações
- Bloco 2 - FarmacologiaDocumento19 páginasBloco 2 - Farmacologiadesafiosbr238Ainda não há avaliações
- Fisiologia Endócrina Do PâncreasDocumento65 páginasFisiologia Endócrina Do Pâncreasapi-26429188100% (4)
- Aula 03 Tutora - Bases Moleculares Da Vida 2Documento23 páginasAula 03 Tutora - Bases Moleculares Da Vida 2Escolinha Do SaberAinda não há avaliações
- Regulação Da Glicemia Completo-1Documento26 páginasRegulação Da Glicemia Completo-1noobizinhon2Ainda não há avaliações
- Apostila DiabetesDocumento36 páginasApostila DiabetesCelso Murilo MartinsAinda não há avaliações
- Aula 5 - DiabetesDocumento65 páginasAula 5 - Diabetesmonalisa.o.maiaAinda não há avaliações
- 6º Aula Jejum e DiabetesDocumento41 páginas6º Aula Jejum e DiabetesLaura Morena FaustoAinda não há avaliações
- Controle Hormonal e Neural Do Metabolismo EnergéticoDocumento7 páginasControle Hormonal e Neural Do Metabolismo EnergéticoKeyla Silva100% (1)
- Fisiopatologia Da Diabetes Mellitus 2023 - FinalDocumento143 páginasFisiopatologia Da Diabetes Mellitus 2023 - FinalEllen Tardelli Falleiros LimaAinda não há avaliações
- Fisiopatologia Diabetes Mellitus Tipo 2Documento34 páginasFisiopatologia Diabetes Mellitus Tipo 2Regina Celia100% (1)
- Fisiopatologia Diabetes Mellitus Tipo 2Documento34 páginasFisiopatologia Diabetes Mellitus Tipo 2paulo100% (1)
- Tutoria 2 - Diabetes PDFDocumento17 páginasTutoria 2 - Diabetes PDFVitor Ferreira BaiaAinda não há avaliações
- Farmacologia Do Sistema Endócrino - LauraDocumento10 páginasFarmacologia Do Sistema Endócrino - LauraLaura PerícoleAinda não há avaliações
- Metabolismo em Jejum - Colunistas - Sanar MedicinaDocumento8 páginasMetabolismo em Jejum - Colunistas - Sanar MedicinaHelder,s Evolution DesignerAinda não há avaliações
- Super Material DMDocumento37 páginasSuper Material DMVitória Novaes100% (1)
- Sistema Digestório - Bioquímica - Passei DiretoDocumento5 páginasSistema Digestório - Bioquímica - Passei DiretoRenata MendesAinda não há avaliações
- Aula 7 - Metabolismo de Carboidratos - GlicliseDocumento33 páginasAula 7 - Metabolismo de Carboidratos - GlicliseTalita Silva santosAinda não há avaliações
- Aula 2Documento24 páginasAula 2Sthefany FrançaAinda não há avaliações
- Roteiro Do Laboratório Morfofuncional: Curso de MedicinaDocumento14 páginasRoteiro Do Laboratório Morfofuncional: Curso de MedicinabluboarettoAinda não há avaliações
- Aula 12 - Glicogênese e Glicogenólise UEPB PDFDocumento4 páginasAula 12 - Glicogênese e Glicogenólise UEPB PDFJoana CordeiroAinda não há avaliações
- Integração Metabólica e OligoelementosDocumento2 páginasIntegração Metabólica e OligoelementosPATRICIA AMORIMAinda não há avaliações
- Diabetes Mellitus Eduarda MarquesDocumento6 páginasDiabetes Mellitus Eduarda MarquesEduarda MarquesAinda não há avaliações
- Metabolismo de Lipídios BGM MDocumento20 páginasMetabolismo de Lipídios BGM MVmoroAinda não há avaliações
- ''Neurotransmissão, SNA, Pares Cranianos, Cerebelo, Ventrículos, Diencéfalo e Telencéfalo'' - Resumo de Neuroanatomia, Por Sofia Azevedo (ATM 2025)Documento26 páginas''Neurotransmissão, SNA, Pares Cranianos, Cerebelo, Ventrículos, Diencéfalo e Telencéfalo'' - Resumo de Neuroanatomia, Por Sofia Azevedo (ATM 2025)rafaela.agnes.gAinda não há avaliações
- BerberinaDocumento1 páginaBerberinaAmanda KrügerAinda não há avaliações
- Degeneracoes Celulares 2018Documento75 páginasDegeneracoes Celulares 2018Ana Cristina DuqueAinda não há avaliações
- CDP4Documento8 páginasCDP4gab.francis2Ainda não há avaliações
- Aula 3 - GliconeogeneseDocumento63 páginasAula 3 - GliconeogeneseThaís FalcoAinda não há avaliações
- 1586883658-Pancreas EndocrinoDocumento9 páginas1586883658-Pancreas EndocrinoCarol GodoyAinda não há avaliações
- Tutoria VitaminasDocumento18 páginasTutoria Vitaminas002-025384Ainda não há avaliações
- Metabolismo Dos Carboidratos, Lipã Dios e Proteã NasDocumento8 páginasMetabolismo Dos Carboidratos, Lipã Dios e Proteã NasCynthia MunizAinda não há avaliações
- Integração MetabólicaDocumento47 páginasIntegração MetabólicaElizael De Jesus Gonçalves100% (1)
- Aula 2 Bioquí - MetabólicaDocumento4 páginasAula 2 Bioquí - Metabólicasamira openAinda não há avaliações
- Insulina e Antidiabéticos: - Classificação Do DiabetesDocumento21 páginasInsulina e Antidiabéticos: - Classificação Do DiabetesCatharina JenischAinda não há avaliações
- Aula 4 - LPF - Diabetes Gestacional - Teste de Tolerância Oral ÀDocumento11 páginasAula 4 - LPF - Diabetes Gestacional - Teste de Tolerância Oral Àgabriella.ferreira.inacioAinda não há avaliações
- Bioquimica MetabólicaDocumento4 páginasBioquimica MetabólicaLilian BertoluciAinda não há avaliações
- Efeitos Metabólicos Da Insulina e Do GlucagonDocumento4 páginasEfeitos Metabólicos Da Insulina e Do Glucagonmarinadsena100% (1)
- Estudo P Bioquim QuestoesDocumento29 páginasEstudo P Bioquim QuestoeslaisrobertaodcAinda não há avaliações
- Djob Urinário Slides-WPS OfficeDocumento19 páginasDjob Urinário Slides-WPS OfficeEnio Ricardo MendonçaAinda não há avaliações
- Farmacologia Do Sistema RespiratorioDocumento81 páginasFarmacologia Do Sistema RespiratorioRodrigo MirandaAinda não há avaliações
- Farmacologia Dos Analgésicos e Anti-InflamatóriosDocumento29 páginasFarmacologia Dos Analgésicos e Anti-InflamatóriosRoberto Tavares MedeirosAinda não há avaliações
- Neurocurso Ebook V1 PDF PDFDocumento62 páginasNeurocurso Ebook V1 PDF PDFLourrany BorgesAinda não há avaliações
- 4simulado r1 Comentario Set2010Documento45 páginas4simulado r1 Comentario Set2010Indianara Valgas100% (1)
- Antianemicos - 2017Documento63 páginasAntianemicos - 2017Ana GarciaAinda não há avaliações
- Tabela de Doenças ViraisDocumento2 páginasTabela de Doenças ViraisthiagooAinda não há avaliações
- Apostila Moxaterapia Protocolos 4Documento147 páginasApostila Moxaterapia Protocolos 4Antonio FranciscoAinda não há avaliações
- Caso 5 - DOENÇA PULMONAR OBSTRUTIVA CRÔNICADocumento35 páginasCaso 5 - DOENÇA PULMONAR OBSTRUTIVA CRÔNICAMeio SangueAinda não há avaliações
- Neurocirurgia Basica - Gusmão PDFDocumento204 páginasNeurocirurgia Basica - Gusmão PDFJames Sales Borges100% (1)
- Emergencias Medicas Mais ComunsDocumento15 páginasEmergencias Medicas Mais ComunsJanaina SantosAinda não há avaliações
- Edital Medico CBMDocumento54 páginasEdital Medico CBMJAinda não há avaliações
- SARAMPODocumento37 páginasSARAMPOAzadAinda não há avaliações
- Prova CBR 2021Documento41 páginasProva CBR 2021Lucas GuadaAinda não há avaliações
- 2 - 8 - Aula 8 - Acumulos Intracelulares e Degeneracao CelularDocumento59 páginas2 - 8 - Aula 8 - Acumulos Intracelulares e Degeneracao CelularJousneid BenilzaAinda não há avaliações
- AIDS em OdontologiaDocumento2 páginasAIDS em OdontologialarissaAinda não há avaliações
- Agentes Alquilantes Reações Adversas e ComplicaçõesDocumento12 páginasAgentes Alquilantes Reações Adversas e ComplicaçõesElizangela SousaAinda não há avaliações
- Resumo para Plantão de Médico 2020 UPA e EmergênciaDocumento30 páginasResumo para Plantão de Médico 2020 UPA e EmergênciaRoberto Npg80% (5)
- ESTUDO DIRIGIDO N2 SemiologiaDocumento15 páginasESTUDO DIRIGIDO N2 SemiologiaLuiza KokkonenAinda não há avaliações
- Artigo - BronquiteDocumento2 páginasArtigo - BronquiteMayara50% (2)
- Bioquímica Hormonal - Livro 1a EdiçãoDocumento21 páginasBioquímica Hormonal - Livro 1a Ediçãokayan MacedoAinda não há avaliações
- EnsaioDocumento131 páginasEnsaioNeto FabalAinda não há avaliações
- Semana Da Aprovacao Sus-Ba - Clinica MedicaDocumento60 páginasSemana Da Aprovacao Sus-Ba - Clinica MedicaFilipe AlbanAinda não há avaliações
- Sindrome PoemsDocumento5 páginasSindrome PoemsNatalie AlcântaraAinda não há avaliações
- Estudo de Caso Grupo 04. CorrigidoDocumento12 páginasEstudo de Caso Grupo 04. CorrigidoFernanda MeloAinda não há avaliações
- Hiv - DipDocumento24 páginasHiv - DipTallita Lougon100% (1)
- Laura Botelho - Alzheimer A Doenca Da AlmaDocumento111 páginasLaura Botelho - Alzheimer A Doenca Da AlmaTyana Oliveira100% (1)
- Medicamentos ProntuarioDocumento25 páginasMedicamentos ProntuarioGrace GMAinda não há avaliações
- TEP Comentado 2019-AutorizadoDocumento52 páginasTEP Comentado 2019-Autorizadogracy kelly kAinda não há avaliações
- Terapia de Purificação Okada MOADocumento229 páginasTerapia de Purificação Okada MOAgilza100% (5)
- Manual Prático de Técnica Operatória e Cirurgia ExperimentalNo EverandManual Prático de Técnica Operatória e Cirurgia ExperimentalNota: 5 de 5 estrelas5/5 (2)
- S.O.S. Autismo: Guia completo para entender o transtorno do espectro autistaNo EverandS.O.S. Autismo: Guia completo para entender o transtorno do espectro autistaNota: 4.5 de 5 estrelas4.5/5 (11)
- Formas lúdicas de investigação em psicologia:: Procedimento de Desenhos-Estórias e Procedimento de Desenhos de Família com EstóriasNo EverandFormas lúdicas de investigação em psicologia:: Procedimento de Desenhos-Estórias e Procedimento de Desenhos de Família com EstóriasNota: 5 de 5 estrelas5/5 (2)
- TDAH em Adultos - Como Reconhecer e Lidar Com Adultos Que Sofrem de TDAH Em 30 Passos SimplesNo EverandTDAH em Adultos - Como Reconhecer e Lidar Com Adultos Que Sofrem de TDAH Em 30 Passos SimplesNota: 4.5 de 5 estrelas4.5/5 (8)
- Dieta pelo tipo sanguíneo: Da ancestralidade à epigenéticaNo EverandDieta pelo tipo sanguíneo: Da ancestralidade à epigenéticaNota: 5 de 5 estrelas5/5 (4)
- A Perda Auditva e a vida : Um guia para os pais sobre cansaço ,demencia ,tinido e vertigemNo EverandA Perda Auditva e a vida : Um guia para os pais sobre cansaço ,demencia ,tinido e vertigemAinda não há avaliações
- Simetria Molecular III: Série Didática para o apoio a formação de professores de QuímicaNo EverandSimetria Molecular III: Série Didática para o apoio a formação de professores de QuímicaAinda não há avaliações
- Transtorno de Personalidade Borderline Mais de 30 segredos para retomar sua vida Ao lidar com TPBNo EverandTranstorno de Personalidade Borderline Mais de 30 segredos para retomar sua vida Ao lidar com TPBNota: 2.5 de 5 estrelas2.5/5 (3)
- Psicopatologia e psicodinâmica na análise psicodramática: Volume IIINo EverandPsicopatologia e psicodinâmica na análise psicodramática: Volume IIIAinda não há avaliações
- O Guia Completo Para Iniciantes da Dieta Cetogênica Zero-LactoseNo EverandO Guia Completo Para Iniciantes da Dieta Cetogênica Zero-LactoseNota: 5 de 5 estrelas5/5 (1)
- Introdução à Modelagem Molecular para Química, Engenharia e Biomédicas: Fundamentos e ExercíciosNo EverandIntrodução à Modelagem Molecular para Química, Engenharia e Biomédicas: Fundamentos e ExercíciosNota: 5 de 5 estrelas5/5 (2)
- Sobre Sensibilidades: Intolerâncias e Alergias Alimentares TardiasNo EverandSobre Sensibilidades: Intolerâncias e Alergias Alimentares TardiasNota: 4.5 de 5 estrelas4.5/5 (3)
- Solicitação e Interpretação de Exames Laboratoriais: Uma visão fundamentada e atualizada sobre a solicitação, interpretação e associação de alterações bioquímicas com o estado nutricional e fisiológico do paciente.No EverandSolicitação e Interpretação de Exames Laboratoriais: Uma visão fundamentada e atualizada sobre a solicitação, interpretação e associação de alterações bioquímicas com o estado nutricional e fisiológico do paciente.Nota: 2 de 5 estrelas2/5 (1)
- Fenômenos psicossomáticos: o manejo da transferênciaNo EverandFenômenos psicossomáticos: o manejo da transferênciaNota: 5 de 5 estrelas5/5 (3)
- Fragmento de uma análise de histeria [O caso Dora]No EverandFragmento de uma análise de histeria [O caso Dora]Nota: 5 de 5 estrelas5/5 (4)
- Medicina integrativa: A cura pelo equilíbrioNo EverandMedicina integrativa: A cura pelo equilíbrioNota: 4.5 de 5 estrelas4.5/5 (7)



















































































































![Fragmento de uma análise de histeria [O caso Dora]](https://imgv2-1-f.scribdassets.com/img/word_document/457949460/149x198/f0012e6e80/1708442340?v=1)
