Escolar Documentos
Profissional Documentos
Cultura Documentos
Bioquímica do fígado: funções, metabolismo de carboidratos, lipoproteínas e xenobióticos
Enviado por
Rafaela Mendes0 notas0% acharam este documento útil (0 voto)
15 visualizações5 páginasEste documento contém 8 perguntas e respostas sobre bioquímica do fígado para um grupo de estudantes de medicina. As principais funções do fígado incluem processar produtos da digestão, armazenar vitaminas e sais minerais, e excretar substâncias como a amônia. O metabolismo de carboidratos difere entre fígado e músculo, e as lipoproteínas variam em composição lipídica e proteica. O LDL desempenha um papel na formação de placas ateroscleróticas e o
Descrição original:
Título original
ED FiÌ_gado
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoEste documento contém 8 perguntas e respostas sobre bioquímica do fígado para um grupo de estudantes de medicina. As principais funções do fígado incluem processar produtos da digestão, armazenar vitaminas e sais minerais, e excretar substâncias como a amônia. O metabolismo de carboidratos difere entre fígado e músculo, e as lipoproteínas variam em composição lipídica e proteica. O LDL desempenha um papel na formação de placas ateroscleróticas e o
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
15 visualizações5 páginasBioquímica do fígado: funções, metabolismo de carboidratos, lipoproteínas e xenobióticos
Enviado por
Rafaela MendesEste documento contém 8 perguntas e respostas sobre bioquímica do fígado para um grupo de estudantes de medicina. As principais funções do fígado incluem processar produtos da digestão, armazenar vitaminas e sais minerais, e excretar substâncias como a amônia. O metabolismo de carboidratos difere entre fígado e músculo, e as lipoproteínas variam em composição lipídica e proteica. O LDL desempenha um papel na formação de placas ateroscleróticas e o
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 5
Universidade do Estado do Rio de Janeiro – UERJ
Curso : Medicina
Disciplina : Bioquímica II
Grupo 04 : Ana Carolina Rodrigues de Oliveira, Bruno Henrique de Castro, Caroline
Fernanda Santos do Monte, Caroline Silva Rodrigues, Cleber da Silva Teixeira Junior,
Gabryella Sabino dos Santos, Ingrid Nogueira Areas, Leticia Barbosa Rangel, Mayara
Vivian Costa de Oliveira, Rafaela Mendes Tobias, Rafaele Dantas Cruz dos Santos,
Sarah Taboada de Souza, Thais Saeger Ruschmann da Costa.
ED - Bioquímica do fígado
Aspectos gerais, Metabolismo delipoproteínas, Metabolismo de colesterol e xenobiótico
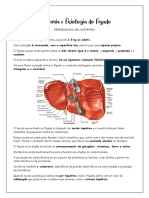
1. Explique 3 diferentes funções do fígado?
Processa produtos da digestão -Os hepatócitos possuem importante função no
metabolismo de carboidratos, lipídios e glicídios, os quais chegam ao fígado
através da veia porta. Enzimas responsáveis pelo metabolismo desses nutrientes
estão contidas no fígado, sendo esse órgão então essencial ao metabolismo
dessas substâncias e na sua distribuição às diversas demandas metabólicas
Armazenamento de vitaminas e sais minerais -Vitaminas, principalmente as
lipossolúveis (A, D, E e K), e os minerais, como o cobre e o ferro, são
armazenados nos hepatócitos.
Excreção- O fígado participa da transformação de amônia em ureia.O
catabolismo de aminoácidos, ou seja, o metabolismo de nitrogênio, resulta na
liberação de compostos que resultam em amônia. Este substância é transportada
para o fígado e para os rins, sendo eliminado do corpo sob a forma de ureia
através da urina. O ciclo da ureia ocorre no fígado e inclui a síntese de ureia a
partir de amônia, CO2, aspartato e bicarbonato.
2.Quais as diferenças entre o metabolismo de carboidratos no fígado e no
músculo?
O fígado e o músculo são capazes de estocar glicose na forma de glicogênio,
mas apenas o fígado poderá quebrar o glicogênio para disponibilizar glicose para
a circulação sistêmica. No fígado, há presença da enzima glicose-6-fosfatase que
converte glicose-6-fosfato em glicose. O músculo, em contraponto, não possui
essa enzima, por isso não consegue utilizar a glicose-6-fosfato proveniente da
glicogenólise, permanecendo no tecido muscular e não sendo levado para a
corrente sanguínea.
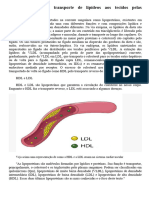
3.Discuta a composição das lipoproteínas com relação a lipídios e
proteínas?
As lipoproteínas são agregados esféricos com lipídeos hidrofóbicos no centro e
cadeias laterais hidrofílicas de proteínas e grupos polares de lipídeos na
superfície. As lipoproteínas são formadas a partir de combinações de lipídeos
com apolipoproteínas (proteínas de ligação a lipídeos no sangue, responsáveis
pelo transporte de triacilgliceróis, fosfolipídeos, colesterol e ésteres de colesterol
entre os órgãos).Diferentes combinações de lipídeos e proteínas produzem
partículas de densidades diferentes, que podem ser: quilomícrons (maiores em
tamanho e menor densidade), lipoproteínas de densidade muito baixa (VLDL),
lipoproteínas de baixa densidade (LDL) e lipoproteínas de alta densidade
(HDL).O quilomícron apresenta baixa densidade, apesar do seu grande tamanho.
Essa característica é decorrente da sua grande quantidade de lipídios totais (em
função da presença de triglicerídeos e colesterol), e um percentual pequeno de
proteínas associados a apolipoproteína. A VLDL possui uma quantidade de lipídio
menor do que a do quilomícron e uma quantidade de proteína maior, fazendo
com que ela tenha uma densidade um pouco maior e com tamanho menor. A
LDL possui 80% de lipídios totais e 20% de proteínas totais, sendo carregada de
ésteres de colesterol. Já o HDL possui 50% de lipídio e 50% de proteína (menor
tamanho e densidade mais elevada).
4.Discuta o papel do LDL na formação da placa aterosclerótica?
A placa aterosclerótica inicia com uma lesão do endotélio, na qual ocorre
acúmulo de lipoproteínas de baixa densidade (LDLs) e LDL oxidadas (alteradas)
na camada íntima do vaso e/ou artéria. Quando ocorre um aumento dos níveis de
LDL, essas partículas são depositadas nas artérias com consequente oxidação e
formação da LDLox. As partículas oxidadas são citotóxicas para as células
endoteliais resultando em lesões.
A deposição lipídica desencadeia uma resposta inflamatória, com adesão de
monócitos ao endotélio; transmigração dos monócitos do endotélio até a camada
íntima, onde se diferenciam em macrófagos. As células endoteliais agredidas
pela lesão aterosclerótica expressam e produzem uma série de moléculas, como
a molécula de adesão intercelular (ICAM-1), E-selectina, a molécula de adesão
vascular (VCAM-1) e a interleucina-8 (IL-8), que, juntamente com os outros
fatores, facilitam a entrada e o recrutamento dessas células para a túnica média
dos vasos.Os macrófagos fagocitam as lipoproteínas, mas por serem incapazes
de eliminar os lipídios fagocitados, acabam se tornando células espumosas.
Quando as células espumosas morrem seu conteúdo lipídico contribui para a
evolução da doença. A própria LDLox é quimiotática para monócitos por meio da
regulação positiva de expressão dos genes para citocinas.
5.O que é o transporte reverso de colesterol?
O transporte reverso de colesterol baseia-se na remoção de colesterol
depositado nos tecidos para ser posteriormente eliminado, removendo o excesso
de colesterol dos tecidos e transporta para utilização de forma que ele não se
acumule. A transferência de colesterol dos tecidos periféricos para a HDL, e da
HDL para o fígado, constitui uma via essencial para a homeostase de colesterol
no organismo. É em razão dela que a HDL é referida popularmente como
“colesterol bom”, já que sua concentração no sangue significa o fluxo de
colesterol dos tecidos para o fígado, diminuindo sua concentração nos tecidos.
As moléculas de colesterol livres em grande quantidade nas células periféricas
causam um aumento da concentração dos chamados oxisteróis, forma oxidada
do colesterol, no meio intracelular. Essas moléculas funcionam como
sinalizadores da concentração de colesterol, e atuam no núcleo celular
estimulando a expressão de genes envolvidos em diversas vias metabólicas. O
efluxo de colesterol livre para o meio extracelular é essencial para que ele seja
captado pela HDL do sangue. Porém, ainda é necessário que esse colesterol
seja esterificado, de modo a impedir que ele retorne ao citoplasma da célula de
origem. Para esse fim, a HDL apresenta, em sua monocamada lipídica, a enzima
LCAT. A LCAT catalisa a reação de transferência de um grupo acil do carbono 2
da fosfatidilcolina (ou lecitina) para a hidroxila do carbono 3 da molécula de
colesterol, formando uma ligação éster. O produto dessa reação será uma
lisolecitina, que se associa à albumina, e um éster de colesterol, que será
armazenado no núcleo central da HDL. A partícula de HDL pode interagir com
outras lipoproteínas presentes na corrente sanguínea. Essa troca permite que
parte do colesterol extraído dos tecidos seja direcionado ao fígado via outras
lipoproteínas, e não só via HDL. A HDL, em sua forma rica em lipídios, após
capturar colesterol dos tecidos periféricos e trocar moléculas com outras
lipoproteínas do sangue (VLDL e LDL), caminha em direção à sua degradação.
As células que realizam o catabolismo da HDL são, principalmente, as células
hepáticas (para a síntese de sais biliares ou simples eliminação pela bile),
embora células de tecidos esteroidogênicos também sejam capazes de extrair o
colesterol dessas partículas para a síntese de hormônios esteróides.
6.Defina um xenobiótico, um pro-fármaco e um pro-carcinógeno?
Todo elemento estranho presente no nosso corpo pode ser chamado de
xenobiótico.Comumente pequenos e lipofílicos, que precisam ser
metabolizados,podendo ou não ter efeito nocivo à saúde, sendo que tal efeito
possui relação com diversos fatores, como por exemplo a quantidade e o tempo
de exposição do indivíduo a alguma substância.
Os pró-fármacos são medicamentos administrados na forma inativa, sendo
ativados somente após biotransformação, a qual ocorre principalmente no fígado
através do metabolismo de xenobióticos. Esse mecanismo pode melhorar a
absorção ou a ação do fármaco. Todavia, em geral, uma droga é administrada na
forma ativa e inativada pela biotransformação.
Pro-carcinógenos são quaisquer substâncias, combinação ou mistura de
substâncias, que causam um aumento da incidência de neoplasias benignas ou
malignas,como a aflatoxina B1, metabolizada pela CYP3A4/2A6 em um
hepatocarcinógeno
7-Explique por que na Fase I do metabolismo dos Xenobióticos um “pro-
fármaco” se torna biologicamente ativo?
A ativação do pró fármaco na fase 1 do metabolismo de xenobióticos ocorre,
principalmente, pela exposição ou adição de componentes polares a partir de
oxidações, reduções e hidrólises, a fim de aumentar a hidrofilia da molécula. As
reações envolvidas no metabolismo podem ser catalisadas por enzimas
microssomais (Flavina monooxigenase e Sistema Citocromo P450) e enzimas
não microssomais (álcool desidrogenase, monoaminoxidase - MAO, aldeído
desidrogenase). Dessa forma, o fármaco, inicialmente inativo, após passar pelo
processo de biotransformação mediado por enzimas como aquelas do Sistema
Citocdomo P450, terá a sua forma ativa mais eficiente na absorção ou ação no
metabolismo de xenobióticos.
8.Como diferentes xenobióticos induzem a expressão de diferentes CYP
P450?
Os xenobióticos induzem os tipos de citocromos p450 a partir de suas
características. Desse modo, diferente xenobióticos induzem certos tipos de
citocromo p450, de acordo com as suas peculiaridades ,podendo induzir o
CYP450, pois eles se ligam à receptores no citoplasma da célula e esse
complexo ligante-receptor vai para o núcleo, onde se liga a uma proteína,
formando um complexo-receptor heterodimérico. Esse complexo se liga em
regiões diferentes do DNA, denominado de elemento de resposta do CYP450,
por isso ocorre ativação da transcrição. Com a síntese aumentada de RNAm, no
citoplasma a isoenzima CYP450 é codificada e posteriormente metaboliza o
xenobiótico. O polimorfismo genético dos citocromos P450 consiste em uma
diferença na sequência de DNA que codifica a expressão das CYP450 e
caracteriza essa diferença na metabolização dos xenobióticos
9.Como o metabolismo de alguns xenobióticos interfere no metabolismo de
outros?
O metabolismo de alguns xenobióticos pode induzir ou inibir competitivamente as
enzimas pertencentes a familia do citocromo P-450, enzimas estas que realizam
a oxidação na fase I do metabolismo. Sendo assim, certos xenobióticos induzem
a síntese dessas enzimas, aumentando a velocidade de reações da fase I.
Entretanto, há xenobióticos que formam um complexo relativamente estável com
o citocromo P-450 e inibem o metabolismo de outros. Dessa forma, existem
substâncias capazes de alterar a ação da enzima CYP, que atua na
metabolização de outros xenobióticos. Por exemplo, o antibiótico ciprofloxacina
atua como uma substância inibidora da CYP1A2, fazendo com que os substratos
normais para CYP1A2 sejam metabolizados mais lentamente e seus níveis
plasmáticos aumentem.
10 .A codeína (droga analgésica) precisa ser metabolizada para gerar sua
forma ativa (morfina), o que requer a participação da enzima CYP2D6.
Discuta as consequências de se administrar a mesma dose desse
analgésico em indivíduos portadores dos alelos CYP2D6*1, *2, *4 e *10.
Dica: consulte a atividade associada a cada um dos alelos.
A seguir, você encontra um quadro com informações sobre alguns polimorfismos
no gene CYP2D6.
Alelo Atividade Comentários
de
CYP2D6
CYP2D6*1 normal Metabolizador normal
CYP2D6*2 ↑ Metabolizador ultra-rápido
CYP2D6*4 ausente Metabolizador ruim ou sem
qualquer atividade
CYP2D6*1 ↓ Metabolizador intermediário
0
CYP2D6*1: por ser a isoforma do metabolizador normal com atividade normal, a
metabolização da codeína vai ter velocidade e o efeito esperados, produzindo
uma quantidade de morfina adequada.
CYP2D6*2: por ser a isoforma do metabolizador ultra rápido com atividade
aumentada, a metabolização da codeína vai ter velocidade e o efeito
exacerbados, produzindo uma maior quantidade de morfina do que o esperado.
CYP2D6*4: por ser a isoforma do metabolizador ruim ou sem qualquer atividade ,
não haverá a metabolização da codeína e, por conseguinte, não haverá a
produção de morfina.
CYP2D6*10: por ser a isoforma do metabolizador intermediário com atividade
reduzida, a metabolização da codeína vai ter velocidade e o efeito reduzidos,
produzindo uma menor quantidade de morfina do que o esperado.
Ao administrar a mesma dose de codeína em indivíduos portadores de diferentes
alelos, os efeitos dependerão da sensibilidade do paciente à droga, fator que é
definido pela atividade enzimática ditada pelo alelo codificador. No indivíduo
portador do alelo CYP2D6*1, por ser a isoforma do metabolizador normal com
atividade normal, a metabolização da codeína vai ter velocidade e o efeito
esperados, produzindo uma quantidade de morfina adequada.
Já no indivíduo portador do alelo CYP2D6*2, devido ao aumento da atividade da
enzima CYP2D6, a metabolização de codeína ficará acelerada, de forma que
doses consideradas normais para indivíduos com metabolização padrão podem
causar concentração de morfina em níveis tóxicos. Esses indivíduos podem
apresentar sintomas tais como confusão, respiração superficial ou sonolência
extrema, o que pode ser fatal.
No indivíduo portador do alelo CYP2D6*10, há uma diminuição branda na
atividade da enzima, o que ocasiona metabolização mais lenta da codeína em
morfina, em comparação com um indivíduo normal. Nesse caso, para a mesma
dose, haverá redução dos níveis de morfina e do efeito de analgesia. No longo
prazo, poderá haver acúmulo de codeína no organismo, causando efeitos
colaterais.
Por fim, no portador do alelo CYP2D6*4, que tem atividade enzimática ausente, a
metabolização da codeína em morfina não ocorrerá, ou seja, não haverá efeito de
analgesia pela morfina e o indivíduo sofrerá com efeitos colaterais do acúmulo de
codeína e reações de intolerância, mesmo em doses consideradas normais para
um indivíduo norma
Você também pode gostar
- Roteiro Do Laboratório Morfofuncional: Curso de MedicinaDocumento30 páginasRoteiro Do Laboratório Morfofuncional: Curso de MedicinabluboarettoAinda não há avaliações
- Roteiro Do Laboratório Morfofuncional: Curso de MedicinaDocumento32 páginasRoteiro Do Laboratório Morfofuncional: Curso de MedicinabluboarettoAinda não há avaliações
- Digestão e Absorção Dos LipídiosDocumento1 páginaDigestão e Absorção Dos Lipídioslilianreis9Ainda não há avaliações
- Metabolismo Do Colesterol - ResumidoDocumento5 páginasMetabolismo Do Colesterol - ResumidoDianaAinda não há avaliações
- Metabolismo dos carboidratos e lipídiosDocumento4 páginasMetabolismo dos carboidratos e lipídiosNetto LacerdaAinda não há avaliações
- Aula Lipoproteinas Corrigida Com Imagem - Docx AnaDocumento10 páginasAula Lipoproteinas Corrigida Com Imagem - Docx AnaAninha SilvaAinda não há avaliações
- LÍPIDOS Metabolismo 11Documento60 páginasLÍPIDOS Metabolismo 11Mirian NaimaAinda não há avaliações
- Diretriz Brasileira Sobre Dislipidemias PDFDocumento18 páginasDiretriz Brasileira Sobre Dislipidemias PDFaafernandsAinda não há avaliações
- Resolução Lista BioquimicaDocumento16 páginasResolução Lista BioquimicaVitor SouzaAinda não há avaliações
- Transcrição Dos Áudios 2 Prova de Bioquímica Clínica IDocumento16 páginasTranscrição Dos Áudios 2 Prova de Bioquímica Clínica ICarol Fernandes de Assis100% (1)
- 1586733641-Metabolismo LipidicoDocumento10 páginas1586733641-Metabolismo LipidicoMarcos HenriquesAinda não há avaliações
- Lesões celulares reversíveis e degeneração gordurosaDocumento4 páginasLesões celulares reversíveis e degeneração gordurosaEnzo RodriguesAinda não há avaliações
- Consenso Brasileiro Sobre DislipidemiasDocumento19 páginasConsenso Brasileiro Sobre DislipidemiasEtiena MaritanAinda não há avaliações
- CMS Sist. Digestório e EndócrinoDocumento17 páginasCMS Sist. Digestório e EndócrinoAnna Belly '-'Ainda não há avaliações
- Transporte e Armazenamento de LipideosDocumento6 páginasTransporte e Armazenamento de LipideosCamila LopesAinda não há avaliações
- Dislipidemia - ResumoDocumento8 páginasDislipidemia - ResumoEduardo BarretoAinda não há avaliações
- Problema 1Documento13 páginasProblema 1Moises Popp de OliveiraAinda não há avaliações
- Esteatose Hepática: Causas e Aspectos MorfológicosDocumento75 páginasEsteatose Hepática: Causas e Aspectos MorfológicosAna Cristina DuqueAinda não há avaliações
- Metabolismo de LipoproteínasDocumento2 páginasMetabolismo de LipoproteínasTatiane Romero100% (2)
- Digestão, absorção e transporte de lipídiosDocumento11 páginasDigestão, absorção e transporte de lipídiosRicardo Junior100% (1)
- Lipidios, Apolipos e LipoproteinasDocumento105 páginasLipidios, Apolipos e LipoproteinasMarval Fone100% (1)
- Doenças HepáticasDocumento68 páginasDoenças HepáticasDaniela Molina Santos100% (1)
- Bioquimica Digestao e Absorcao Dos LipidiosDocumento5 páginasBioquimica Digestao e Absorcao Dos LipidiosdalilaAinda não há avaliações
- Problema 03 11Documento20 páginasProblema 03 11Ricardo Vitor Mesquita BedettiAinda não há avaliações
- DislipidemiaDocumento14 páginasDislipidemiajoao bernacchiAinda não há avaliações
- Tia JocaDocumento11 páginasTia JocaThiago R. N. SilvaAinda não há avaliações
- Carboidratos bioquímica clínicaDocumento4 páginasCarboidratos bioquímica clínicaMárcio MesquitaAinda não há avaliações
- 15 - Biossíntese Do Colesterol PDFDocumento5 páginas15 - Biossíntese Do Colesterol PDFIvone Pires PortoAinda não há avaliações
- Sistema Digestório - Colesterol PDFDocumento7 páginasSistema Digestório - Colesterol PDFPolliana CastroAinda não há avaliações
- FicatDocumento8 páginasFicatEllena CristianaAinda não há avaliações
- Aula 6 Lipídeos, Lipoproteínas e ApolipoproteínasDocumento50 páginasAula 6 Lipídeos, Lipoproteínas e ApolipoproteínasLídia Rosa100% (1)
- Oxidação Dos Ácidos GraxosDocumento5 páginasOxidação Dos Ácidos GraxosBruna NevesAinda não há avaliações
- Bioquimica Prova 3Documento7 páginasBioquimica Prova 3LuanaAinda não há avaliações
- Metabolismo de LipídiosDocumento12 páginasMetabolismo de LipídiosDenisar PalmitoAinda não há avaliações
- Dislipidemias e Prevenção Da AteroscleroseDocumento9 páginasDislipidemias e Prevenção Da AteroscleroseAlice MirandaAinda não há avaliações
- Questoes BioquimicaDocumento12 páginasQuestoes BioquimicaGleycimara Patricia100% (5)
- Síntese e Funções do ColesterolDocumento7 páginasSíntese e Funções do ColesterolThauanny AlmeidaAinda não há avaliações
- Funções Do Tecido HepáticoDocumento3 páginasFunções Do Tecido HepáticoCarlos Henrique Guimarães -2BMAinda não há avaliações
- Fisiologia HepáticaDocumento3 páginasFisiologia HepáticaNusia MotaAinda não há avaliações
- BIOQUIMICADocumento42 páginasBIOQUIMICAEdivaldo PinheiroAinda não há avaliações
- Processos metabólicos no fígadoDocumento7 páginasProcessos metabólicos no fígadoAlana Maria Cerqueira de OliveiraAinda não há avaliações
- YXBvc3RpbGEtYmlvcXVpbWljYS1kYS1jZWx1bGEyMDA0MjAxN1QwNTExDocumento14 páginasYXBvc3RpbGEtYmlvcXVpbWljYS1kYS1jZWx1bGEyMDA0MjAxN1QwNTExMaria Clara Bezerra da SilvaAinda não há avaliações
- Metabolismo energético: aspectos-chaveDocumento28 páginasMetabolismo energético: aspectos-chavePaulo Ferreira100% (1)
- E-Book Lipídios - NAPEDocumento26 páginasE-Book Lipídios - NAPEDiego SantosAinda não há avaliações
- Metabolismo Energético Nos AnimaisDocumento19 páginasMetabolismo Energético Nos AnimaisPaulo HenriqueAinda não há avaliações
- Transporte colesterol sangueDocumento4 páginasTransporte colesterol sangueJennyfer Balbuena BarbosaAinda não há avaliações
- Resumo - Integração MetabólicaDocumento18 páginasResumo - Integração MetabólicamuradihachichuanAinda não há avaliações
- BioquimicaDocumento6 páginasBioquimicakesianadielyAinda não há avaliações
- O que é metabolismo e como funciona o catabolismo da glicoseDocumento13 páginasO que é metabolismo e como funciona o catabolismo da glicoseBeatriz TiveronAinda não há avaliações
- LipídiosDocumento9 páginasLipídiosAMANDA SANTOS ABREUAinda não há avaliações
- Anatomia e fisiologia do fígadoDocumento14 páginasAnatomia e fisiologia do fígadoAnna Belly '-'Ainda não há avaliações
- Resumo TopTopíssimo 2 PDFDocumento43 páginasResumo TopTopíssimo 2 PDFSofia SanchesAinda não há avaliações
- Lipideos 3Documento42 páginasLipideos 3Diéssica AlvesAinda não há avaliações
- Introdução Ao Metabolismo - Glicólise - Ciclo de Krebs - Fosforilação OxidativaDocumento86 páginasIntrodução Ao Metabolismo - Glicólise - Ciclo de Krebs - Fosforilação OxidativaMaria Theresa ReisAinda não há avaliações
- Aula 5 - LipoproteinasDocumento4 páginasAula 5 - LipoproteinasArielle MoraesAinda não há avaliações
- Como Ocorre o Transporte de Lipídeos Aos Tecidos Pelas Lipoproteínas4Documento2 páginasComo Ocorre o Transporte de Lipídeos Aos Tecidos Pelas Lipoproteínas4Sanderson Samid de Vasconcelos MaiaAinda não há avaliações
- Bioquímica 2 - Síntese de Acídos GraxosDocumento10 páginasBioquímica 2 - Síntese de Acídos GraxosGiulliene SousaAinda não há avaliações
- Seu metabolismo é incrível: E é fácil compreender como funcionaNo EverandSeu metabolismo é incrível: E é fácil compreender como funcionaAinda não há avaliações
- Fisiologia renal: homeostasia e funções dos rinsDocumento17 páginasFisiologia renal: homeostasia e funções dos rinsRafaela MendesAinda não há avaliações
- Ed HistologiaDocumento1 páginaEd HistologiaRafaela MendesAinda não há avaliações
- Abbinhas PDFDocumento53 páginasAbbinhas PDFRayssa DuarteAinda não há avaliações
- Entrevista revela desafios de saúde em região nobreDocumento4 páginasEntrevista revela desafios de saúde em região nobreRafaela MendesAinda não há avaliações
- 11resumo Filtraã Ã o Glomerular - Jaleko FinalDocumento12 páginas11resumo Filtraã Ã o Glomerular - Jaleko FinalRafaela MendesAinda não há avaliações
- Embriologia do Sistema DigestórioDocumento2 páginasEmbriologia do Sistema DigestórioRafaela MendesAinda não há avaliações
- Questões SimuladoDocumento3 páginasQuestões SimuladoRafaela MendesAinda não há avaliações
- Questões de Anatomia da Prova de Transferência Externa de MedicinaDocumento23 páginasQuestões de Anatomia da Prova de Transferência Externa de Medicinamauricio da silva barbosaAinda não há avaliações
- Aparelho faríngeo e desenvolvimento facialDocumento1 páginaAparelho faríngeo e desenvolvimento facialRafaela MendesAinda não há avaliações
- Sistema endócrino histologiaDocumento11 páginasSistema endócrino histologiaRafaela MendesAinda não há avaliações
- KDocumento1 páginaKRafaela MendesAinda não há avaliações
- Modelo ajuste induzido enzimas mais aceitoDocumento1 páginaModelo ajuste induzido enzimas mais aceitoRafaela MendesAinda não há avaliações
- Funções do sangue, hemostasia e testes laboratoriaisDocumento1 páginaFunções do sangue, hemostasia e testes laboratoriaisRafaela MendesAinda não há avaliações
- Fundamentos E Tecnologias para O Enfrentamento Da Covid-19 E de Outras Doenças ViraisDocumento222 páginasFundamentos E Tecnologias para O Enfrentamento Da Covid-19 E de Outras Doenças ViraisRafaela MendesAinda não há avaliações
- ED4 SISTEMA DIGESTÓRIO II Glândulas - Fígado e Pâncreas AVA FCM 13 12 22Documento3 páginasED4 SISTEMA DIGESTÓRIO II Glândulas - Fígado e Pâncreas AVA FCM 13 12 22Rafaela MendesAinda não há avaliações
- Introdução à APS e abordagem comunitáriaDocumento29 páginasIntrodução à APS e abordagem comunitáriaRafaela MendesAinda não há avaliações
- Auto-Imunidade Celular BiomedDocumento47 páginasAuto-Imunidade Celular BiomedRafaela MendesAinda não há avaliações
- Aula 26 Diferenciacao de Linfocitos BDocumento27 páginasAula 26 Diferenciacao de Linfocitos BRafaela MendesAinda não há avaliações
- Adote um cão e melhore vidasDocumento28 páginasAdote um cão e melhore vidasRafaela MendesAinda não há avaliações
- Bucomaxilo ProvaDocumento7 páginasBucomaxilo ProvalunabiancacastroAinda não há avaliações
- Catalogo 1expDocumento32 páginasCatalogo 1expLaura B CésarAinda não há avaliações
- PUERPÉRIO NORMAL E PATOLÓGICODocumento17 páginasPUERPÉRIO NORMAL E PATOLÓGICOfabio constancio almeida dfa silva100% (1)
- Alcalóides Isoquinolínicos PDFDocumento34 páginasAlcalóides Isoquinolínicos PDFJosyane Aparecida BezerraAinda não há avaliações
- Fundamentos Da Enfermagem em Urgência e EmergênciaDocumento63 páginasFundamentos Da Enfermagem em Urgência e EmergênciaPROPOSTAS PARECERAinda não há avaliações
- Analgésicos Opioides e HipnoanalgésicosDocumento2 páginasAnalgésicos Opioides e HipnoanalgésicosThays Oliveira MarquesAinda não há avaliações
- Fundamentos Da Enfermagem em Urgência e EmergênciaDocumento65 páginasFundamentos Da Enfermagem em Urgência e EmergênciaCíntia PintoAinda não há avaliações
- Dor - Farmacologia dos AnalgésicosDocumento2 páginasDor - Farmacologia dos AnalgésicosWalter FonsecaAinda não há avaliações
- Bioquímica do fígado: funções, metabolismo de carboidratos, lipoproteínas e xenobióticosDocumento5 páginasBioquímica do fígado: funções, metabolismo de carboidratos, lipoproteínas e xenobióticosRafaela MendesAinda não há avaliações
- Farmacologia Clínica Aula 08 OpioidesDocumento41 páginasFarmacologia Clínica Aula 08 OpioidesCaique AndréAinda não há avaliações
- Fármacos Que Atuam No Sistema RespiratórioDocumento34 páginasFármacos Que Atuam No Sistema RespiratórioNadja MarrielAinda não há avaliações
- Medicamentos SusDocumento22 páginasMedicamentos SusJamesTheodoreAinda não há avaliações
- OpioidesDocumento26 páginasOpioidesgabriel tbAinda não há avaliações
- Medicação Pré AnestesicaDocumento61 páginasMedicação Pré AnestesicaGabriel MartinsAinda não há avaliações
- Codaten - Bula CodatenDocumento7 páginasCodaten - Bula CodatenAldemir Fernando BattagliaAinda não há avaliações
- QUÍMICA FARMACÊUTICA II: HIPNOANALGÉSICOS (Analgésicos OpióidesDocumento28 páginasQUÍMICA FARMACÊUTICA II: HIPNOANALGÉSICOS (Analgésicos OpióidesAurelio Henrique Poley MalaccoAinda não há avaliações
- Protocolo HemoterapiaDocumento273 páginasProtocolo HemoterapiaRafaela Farias FonsecaAinda não há avaliações
- OpioidesDocumento12 páginasOpioideshellobizz18Ainda não há avaliações
- Acetilcolina, colinérgicos e anticolinérgicosDocumento26 páginasAcetilcolina, colinérgicos e anticolinérgicosErik JansenAinda não há avaliações
- Protocolo Assistencial de Dor em Adultos 2019Documento14 páginasProtocolo Assistencial de Dor em Adultos 2019Eugênio Patricio de OliveiraAinda não há avaliações
- Alcalóides emDocumento90 páginasAlcalóides emIsabela Honorato0% (1)
- Coda TenDocumento15 páginasCoda Tenroberval nascimentoAinda não há avaliações
- Química dos Analgésicos OpióidesDocumento44 páginasQuímica dos Analgésicos OpióidesJoão Marcelo Nabas100% (1)
- Analgésicos opioides: propriedades, indicações e efeitos colateraisDocumento5 páginasAnalgésicos opioides: propriedades, indicações e efeitos colateraisGuilherme GomesAinda não há avaliações
- Antiinflamatórios: eicosanoides e principais classesDocumento36 páginasAntiinflamatórios: eicosanoides e principais classesana claraAinda não há avaliações
- Aula Farmacologia Da Dor - OpióidesDocumento50 páginasAula Farmacologia Da Dor - OpióidesAnderson SilvaAinda não há avaliações
- Analgésicos opioides: propriedades e usosDocumento6 páginasAnalgésicos opioides: propriedades e usosVitor Arraes RodriguesAinda não há avaliações
- Apostila Medicações e Pós-OperatórioDocumento27 páginasApostila Medicações e Pós-OperatórioMarcelo LustosaAinda não há avaliações
- OPIÓIDESDocumento22 páginasOPIÓIDESLais Souza SoaresAinda não há avaliações
- 3 - Analalgesicos e AnsioliticosDocumento132 páginas3 - Analalgesicos e Ansioliticosrobertoflycat22Ainda não há avaliações