Escolar Documentos
Profissional Documentos
Cultura Documentos
Aminoácidos 2023
Enviado por
Kaylane Xavier Rodrigues0 notas0% acharam este documento útil (0 voto)
24 visualizações17 páginasO documento descreve a estrutura e classificação dos principais aminoácidos. Ele discute a estrutura dos aminoácidos, incluindo a presença de grupos amino e carboxila no carbono alfa, e como a cadeia lateral determina a identidade de cada aminoácido. Também aborda a estereoisomeria dos aminoácidos, classificação por propriedades da cadeia lateral, e existência de aminoácidos incomuns.
Descrição original:
Título original
Aminoácidos_2023.pptx
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PPTX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoO documento descreve a estrutura e classificação dos principais aminoácidos. Ele discute a estrutura dos aminoácidos, incluindo a presença de grupos amino e carboxila no carbono alfa, e como a cadeia lateral determina a identidade de cada aminoácido. Também aborda a estereoisomeria dos aminoácidos, classificação por propriedades da cadeia lateral, e existência de aminoácidos incomuns.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
24 visualizações17 páginasAminoácidos 2023
Enviado por
Kaylane Xavier RodriguesO documento descreve a estrutura e classificação dos principais aminoácidos. Ele discute a estrutura dos aminoácidos, incluindo a presença de grupos amino e carboxila no carbono alfa, e como a cadeia lateral determina a identidade de cada aminoácido. Também aborda a estereoisomeria dos aminoácidos, classificação por propriedades da cadeia lateral, e existência de aminoácidos incomuns.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
Você está na página 1de 17
Aminoácidos
Estrutura e classificações dos principais aminoácidos
Funções gerais dos aminoácidos
Caracterização estrutural
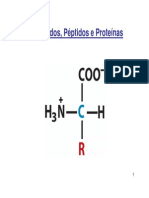
Todo aminoácido é
caracterizado pela presença
de um grupamento amino e
um grupamento carboxílico
ligados ao carbono α (alfa).
Dessa forma, são
denominados α-aminoácidos;
Além desses grupamentos, o
carbono alfa também está
ligado ao átomo de
Hidrogênio e uma cadeia
lateral, ou grupamento R,
responsável pela identidade
do aminoácido.
Estereoisomeria nos aminoácidos – carbono alfa como
centro quiral
Aminoácidos Esteroisômeros - Enantiômeros
• Todos as moléculas com um centro quiral apresentam atividade óptica,
isto é, elas giram o plano da luz polarizada. Historicamente, as
designações semelhantes L e D eram utilizadas para levorrotatória
(rotação da luz polarizada à esquerda) e dextrorrotatória (rotação da
luz polarizada à direita).
• “Quase todos os compostos biológicos com centro quiral ocorrem
naturalmente em apenas uma forma estereoisomérica, D ou L. Os
resíduos de aminoácidos em moléculas proteicas são exclusivamente
estereoisômeros L”
• “Os resíduos de D-aminoácidos foram encontrados apenas em alguns
peptídeos, geralmente pequenos, incluindo alguns peptídeos de
paredes celulares bacterianas e certos antibióticos peptídicos” (Nelson;
Cox, 2019).
Classificação dos aminoácidos pelo grupamento
R
• Grupos R apolares, alifáticos Os grupos R nesta classe de
aminoácidos são apolares e hidrofóbicos. As cadeias laterais de
alanina, valina, leucina e isoleucina tendem a se agrupar no interior
de proteínas, estabilizando a estrutura proteica por meio de
interações hidrofóbicas;
• Grupos R aromáticos - com suas cadeias laterais aromáticas (anel
benzeno), são relativamente apolares (hidrofóbicos);
• Grupos R polares, não carregados - Os grupos R desses aminoácidos
são mais solúveis em água, ou mais hidrofílicos do que aqueles dos
aminoácidos apolares, porque eles contêm grupos funcionais que
formam ligações de hidrogênio com a água. São encontrados na
superfície de proteínas que atuam em ambiente aquoso e no interior
de proteínas associadas a membranas.
Classificação dos aminoácidos pelo
grupamento R
• Grupos R carregados positivamente (básicos) - Os grupos R mais
hidrofílicos são aqueles carregados positivamente ou negativamente;
• Grupos R carregados negativamente (ácidos) - Os dois aminoácidos
que apresentam grupos R com carga negativa final em pH 7,0 são o
aspartato e o glutamato, cada um dos quais tem um segundo grupo
carboxila.
Aminoácidos incomuns
• Além dos 20 aminoácidos comuns, as proteínas podem conter resíduos
criados por modificações de resíduos comuns já incorporados em um
polipeptídeo ;
• 4-hidroxiprolina, um derivado da prolina, e a 5-hidroxilisina, derivada da
lisina são encontrados no colágeno;
• A 6-N-metil-lisina é um constituinte da miosina, uma proteína contrátil do
músculo;
• Outro aminoácido incomum importante é o g-carboxiglutamato,
encontrado na proteína de coagulação protrombina e em algumas outras
proteínas que se ligam ao Ca+2 como parte de suas funções biológicas.
• Outros tantos aminoácidos podem apresentar funções diversas, incluindo o
papel de intermediários em vias metabólicas, como Citrulina e Ornitina,
participantes do ciclo da ureia.
Aminoácidos podem agir como ácidos e
bases
• Os grupos amino e carboxila de aminoácidos, em conjunto com os
grupos ionizáveis R de alguns aminoácidos, funcionam como ácidos e
bases fracos.
• Quando um aminoácido sem um grupo R ionizável é dissolvido em
água em pH neutro, ele permanece na solução como um íon bipolar,
• ou zwitterion (do alemão “íon híbrido”), que pode agir como ácido ou
base
Comportamento acidobásico dos aminoácidos
Classificação dos aminoácidos quanto à
capacidade de biossíntese
Você também pode gostar
- Aula 03 - Aminoácidos e Peptídeos PDFDocumento28 páginasAula 03 - Aminoácidos e Peptídeos PDFMaurício RibeiroAinda não há avaliações
- Bioquímica - Resumo Das AulasDocumento14 páginasBioquímica - Resumo Das AulasrogerfpaAinda não há avaliações
- Bioquimica ProteinasDocumento46 páginasBioquimica ProteinasJuvêncio ChigonaAinda não há avaliações
- Aminoácidos Grupo RDocumento5 páginasAminoácidos Grupo RevelizebarbosaAinda não há avaliações
- Aula 2. AminoácidosDocumento14 páginasAula 2. Aminoácidoskmepina netoAinda não há avaliações
- Resumo Bioquimica BásicaDocumento27 páginasResumo Bioquimica BásicaRômulo CampiAinda não há avaliações
- Resumo Bioquímica Geral Inês MartinsDocumento31 páginasResumo Bioquímica Geral Inês MartinsDaniela CardosoAinda não há avaliações
- AminoácidosDocumento53 páginasAminoácidosmonekobeAinda não há avaliações
- Protein AsDocumento63 páginasProtein AsSteicy MorgadoAinda não há avaliações
- Resumão BiokillDocumento4 páginasResumão BiokillTiago SantosAinda não há avaliações
- Notas e Resumos de BioquímicaDocumento17 páginasNotas e Resumos de BioquímicalsugarleuAinda não há avaliações
- AMINOÁCIDOSDocumento4 páginasAMINOÁCIDOS2022104560Ainda não há avaliações
- AminoácidosDocumento4 páginasAminoácidosLeticia SilvaAinda não há avaliações
- Aminoácidos MiquiriceDocumento8 páginasAminoácidos MiquiriceLaurindo Americo ChivalAinda não há avaliações
- Tarefa BioquimicaDocumento2 páginasTarefa BioquimicaLucas CortezeAinda não há avaliações
- Aminoácidos e ProteinasDocumento7 páginasAminoácidos e ProteinasAdérito BárberAinda não há avaliações
- Resumo p1Documento8 páginasResumo p1Igor Tiosso BatistettiAinda não há avaliações
- Aula 7 - BneDocumento37 páginasAula 7 - BnediassupretaAinda não há avaliações
- Aula 9 - Aminoácidos, Peptídeos e ProteínasDocumento45 páginasAula 9 - Aminoácidos, Peptídeos e ProteínasLucas BatistaAinda não há avaliações
- Resumo Aminoácidos e ProteínasDocumento4 páginasResumo Aminoácidos e ProteínasIngrid OliveiraAinda não há avaliações
- Proteína 1Documento36 páginasProteína 1Helder JamsAinda não há avaliações
- Aminoacidos e Peptideos - BioquimicaDocumento50 páginasAminoacidos e Peptideos - BioquimicaJoão Pedro FigueirêdoAinda não há avaliações
- Aminoácidos - Aula 1Documento4 páginasAminoácidos - Aula 1juliana duarteAinda não há avaliações
- 1 - AminoácidosDocumento7 páginas1 - AminoácidosFelipe RostirollaAinda não há avaliações
- Aula 4 - Aa. e ProteínasDocumento36 páginasAula 4 - Aa. e ProteínasCanal Oseias e PrimosAinda não há avaliações
- Bioquímica - Aminoácidos, Peptídeos e ProteínasDocumento10 páginasBioquímica - Aminoácidos, Peptídeos e ProteínasLeandroNunesAzevedoAinda não há avaliações
- Proteínas GsaDocumento95 páginasProteínas Gsatsp silvaAinda não há avaliações
- Metabolismo Das Proteínas, Síntese, Ciclo Da Ureia e IcteríciaDocumento35 páginasMetabolismo Das Proteínas, Síntese, Ciclo Da Ureia e IcteríciaLaila LongenAinda não há avaliações
- Aminoacidos e PeptideosDocumento37 páginasAminoacidos e PeptideosEricaAinda não há avaliações
- Aminoácidos, Peptídeos e ProteínasDocumento53 páginasAminoácidos, Peptídeos e ProteínasFernando BritoAinda não há avaliações
- AULA 3 e 4. AMINOACIDOS, PEPTIDEOS E PROTEINASDocumento57 páginasAULA 3 e 4. AMINOACIDOS, PEPTIDEOS E PROTEINASStefany CamposAinda não há avaliações
- Aula 02 - Aminoácidos e Proteínas-1Documento54 páginasAula 02 - Aminoácidos e Proteínas-1Gabriel Bahia dos AnjosAinda não há avaliações
- Aula AminoacidosDocumento31 páginasAula AminoacidosAlfredo Lima JùniorAinda não há avaliações
- 03 - AminoácidosDocumento37 páginas03 - AminoácidosLetícia SilvaAinda não há avaliações
- 2aula Aminoacidos (Modo de Compatibilidade)Documento38 páginas2aula Aminoacidos (Modo de Compatibilidade)Elizael De Jesus GonçalvesAinda não há avaliações
- Bio Qui MicaDocumento7 páginasBio Qui MicaJuliane SabrinaAinda não há avaliações
- AMINOÁCIDOSDocumento2 páginasAMINOÁCIDOSJuarez NetoAinda não há avaliações
- Aula 2 Proteinas Aminoacidos 2018Documento31 páginasAula 2 Proteinas Aminoacidos 2018nsutilidadesdomesticasAinda não há avaliações
- ProteínasDocumento53 páginasProteínasLaura Fernandes AntunesAinda não há avaliações
- Aula 5 ProteinasDocumento79 páginasAula 5 ProteinasNorvaldo PedroAinda não há avaliações
- AminoácidosDocumento87 páginasAminoácidosIsabela RochaAinda não há avaliações
- Estudo Dirigido - AminoacidosDocumento5 páginasEstudo Dirigido - Aminoacidos06698100% (40)
- Aminoácidos e ProteínasDocumento50 páginasAminoácidos e ProteínasRafael faruqueAinda não há avaliações
- BioquimicaDocumento6 páginasBioquimicaana290392Ainda não há avaliações
- 1química e Metabolismo de Aminoácidos - MaxDocumento42 páginas1química e Metabolismo de Aminoácidos - MaxhhfzpmbvhsAinda não há avaliações
- Estudo Dirigido de Aminoácidos e Proteínas - Documentos GoogleDocumento4 páginasEstudo Dirigido de Aminoácidos e Proteínas - Documentos Googlesilveira silveiraAinda não há avaliações
- Aminoácidos e ProteinasDocumento71 páginasAminoácidos e Proteinasluzalbuquerque4545Ainda não há avaliações
- 21022019163425bioquímica - Aminoácidos, Peptídeos e Proteínas PDFDocumento24 páginas21022019163425bioquímica - Aminoácidos, Peptídeos e Proteínas PDFmaites miguelAinda não há avaliações
- Princípios de Bioquímica de Lehninger 6 EdiçãoDocumento53 páginasPrincípios de Bioquímica de Lehninger 6 EdiçãoAldelainy Menezes Da SilvaAinda não há avaliações
- Apostila Biomoléculas FSA PDFDocumento52 páginasApostila Biomoléculas FSA PDFVivian BorgesAinda não há avaliações
- Aula Aminoácidos AtualDocumento80 páginasAula Aminoácidos AtualGabryel LeiteAinda não há avaliações
- RESUMO Bioquímica AminoácidosDocumento13 páginasRESUMO Bioquímica AminoácidosAnaAinda não há avaliações
- Seminario ProteinasDocumento103 páginasSeminario ProteinasHeloisa Briganti Rodrigues AsenhaAinda não há avaliações
- AMINOACIDOSDocumento8 páginasAMINOACIDOSMarilia AbreuAinda não há avaliações
- Aminoácidos e Proteínas Pgs 9 A 13 e 17 PDFDocumento20 páginasAminoácidos e Proteínas Pgs 9 A 13 e 17 PDFAna EmíliaAinda não há avaliações
- Trabalho de QuimicaDocumento12 páginasTrabalho de Quimicapaulo gasparAinda não há avaliações
- Teorico IVDocumento21 páginasTeorico IVViviane Silva SommaAinda não há avaliações
- Resumo AminoácidosDocumento4 páginasResumo AminoácidosHeloisa Moreira Dias PereiraAinda não há avaliações
- Enzimas 2023Documento43 páginasEnzimas 2023Kaylane Xavier RodriguesAinda não há avaliações
- Sistematização 01 Kaylane PDFDocumento7 páginasSistematização 01 Kaylane PDFKaylane Xavier Rodrigues100% (1)
- SoluçõesDocumento9 páginasSoluçõesKaylane Xavier RodriguesAinda não há avaliações
- Proteínas 2023Documento28 páginasProteínas 2023Kaylane Xavier RodriguesAinda não há avaliações
- Resumo UA de Bioquimica PDF - 230413 - 112604Documento3 páginasResumo UA de Bioquimica PDF - 230413 - 112604Kaylane Xavier RodriguesAinda não há avaliações
- Pan Mutum Do Sudeste SumarioDocumento8 páginasPan Mutum Do Sudeste Sumarioclara22anjoAinda não há avaliações
- Texto Sobre Legalização Da MaconhaDocumento1 páginaTexto Sobre Legalização Da MaconhaAmareloAinda não há avaliações
- Modelo Recurso de Multa - Estado de NecessidadeDocumento7 páginasModelo Recurso de Multa - Estado de Necessidadeandrewsferruccio67% (3)
- BetoneiraDocumento31 páginasBetoneiraedusampaioAinda não há avaliações
- Fotografia e Modernidade PDFDocumento20 páginasFotografia e Modernidade PDFJorgeLuciodeCamposAinda não há avaliações
- Etica No Trabalho PsicopedagogicoDocumento45 páginasEtica No Trabalho PsicopedagogicoProf. Guilherme GonçalvesAinda não há avaliações
- Boas Práticas de Manipulação de Produtos EstéreisDocumento12 páginasBoas Práticas de Manipulação de Produtos EstéreisgbmmmAinda não há avaliações
- Bula 1661445962942Documento12 páginasBula 1661445962942Marco AntonioAinda não há avaliações
- Homeopatia e Principios Alquimicos - Agricultura OrganicaDocumento186 páginasHomeopatia e Principios Alquimicos - Agricultura OrganicaBruna Ribas Russ100% (1)
- 0730 - Monitorização e Medição de ProcessosDocumento114 páginas0730 - Monitorização e Medição de Processosisabel roseiro100% (1)
- C1R - Lista 16Documento1 páginaC1R - Lista 16Ianka NunesAinda não há avaliações
- Erich Von Daniken - O Dia em Que Os Deuses ChegaramDocumento115 páginasErich Von Daniken - O Dia em Que Os Deuses ChegaramGinamagalhãesAinda não há avaliações
- Cartas Às Missoes Estrangeiras em NY - Alberto C.C. RibeiroDocumento112 páginasCartas Às Missoes Estrangeiras em NY - Alberto C.C. RibeiroWesley Porfírio NobreAinda não há avaliações
- Poema Falado - : Língua PortuguesaDocumento19 páginasPoema Falado - : Língua PortuguesadkauangoudAinda não há avaliações
- Nom#25 Fevereiro2020 PDFDocumento81 páginasNom#25 Fevereiro2020 PDFMagusAndréLAinda não há avaliações
- Curso - ANIMISMODocumento43 páginasCurso - ANIMISMOcelsobarretoAinda não há avaliações
- A Lua No CinemaDocumento5 páginasA Lua No CinemaMilena GuedesAinda não há avaliações
- Edital 31020703Documento16 páginasEdital 31020703WILLIAN OLIVEIRAAinda não há avaliações
- Exercícios de Reprodução Sexuada e AssexuadaDocumento2 páginasExercícios de Reprodução Sexuada e AssexuadaSheila Souza Vieira100% (4)
- S Ou Z e Outros para DitadoDocumento47 páginasS Ou Z e Outros para DitadoAlbertefernandaOliveiraAinda não há avaliações
- Tóp Revolução Inglesa, Revolução Francesa, Rev Americana Independencia América EspanholaDocumento2 páginasTóp Revolução Inglesa, Revolução Francesa, Rev Americana Independencia América EspanholaHellen OliveiraAinda não há avaliações
- Luiza Mahin - Uma Rainha Africana No BrasilDocumento76 páginasLuiza Mahin - Uma Rainha Africana No BrasilCarol SantosAinda não há avaliações
- MG Estado de Minas 021223Documento47 páginasMG Estado de Minas 021223catinga46Ainda não há avaliações
- Trabalho Sobre Metodos de Gestao de StockDocumento19 páginasTrabalho Sobre Metodos de Gestao de Stockjoao sitoeAinda não há avaliações
- Devoção Dos Cinco Primeiros SábadosDocumento2 páginasDevoção Dos Cinco Primeiros SábadosCleiton B CostaAinda não há avaliações
- Entrevista Com Os Pais Modelo AberasturyDocumento8 páginasEntrevista Com Os Pais Modelo AberasturyNarriman BasilioAinda não há avaliações
- Exercitando (Aula01 Top1)Documento1 páginaExercitando (Aula01 Top1)Zaquiel AndradeAinda não há avaliações
- 1º Teste Geografia 1º PERIODO ESAGDocumento4 páginas1º Teste Geografia 1º PERIODO ESAGLinda PereiraAinda não há avaliações
- Aje SalugaDocumento3 páginasAje Salugawalney0% (1)
- Cantos Do Tempo Pascal 2022Documento2 páginasCantos Do Tempo Pascal 2022Igor FernandesAinda não há avaliações